
科目:高中化学 来源: 题型:选择题
| A. | 铁原子的质量数均为60 | |
| B. | ${\;}_{26}^{60}$Fe的核内质子数比中子数多8 | |
| C. | 1mol${\;}_{26}^{58}$Fe与足量盐酸反应时均可得到1mol H2 | |
| D. | 等物质的量的${\;}_{26}^{60}$Fe与1mol ${\;}_{26}^{58}$Fe,前者质量比后者多2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CH3COOH HCl CH3COONa | B. | H2SO4 (NH4)2SO4 CH3COONa | ||
| C. | (NH4)2SO4 CH3COOH NaOH | D. | (NH4)2SO4 NH4Cl CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
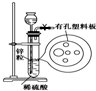 如图为实验室制氢气的简易装置.若在加稀硫酸时发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简易装置.若在加稀硫酸时发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是( )| A. | ①③⑤ | B. | ①②③ | C. | ④⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
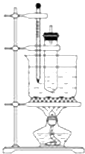 苯与浓硝酸的反应:实验室制备硝基苯的实验装置如下图所示,主要步骤如下:
苯与浓硝酸的反应:实验室制备硝基苯的实验装置如下图所示,主要步骤如下: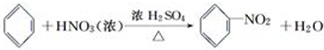 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
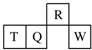 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的非金属性强于Q的非金属性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com