
【题目】I “碘钟”实验中,3I-+S2O82-===I3—+2SO42-的反应速率可以用![]() 遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c(S2O82-)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1)该实验的目的是____________________________________________________________。
(2)显色时间t1为________。
(3)通过分析比较上述数据,得到的结论是___________________________________________________。
II根据反应4FeS2+11O2===2Fe2O3+8SO2,试回答下列问题。
(1)通常选用哪些物质来表示该反应的化学反应速率____________。
(2)当生成SO2的速率为0.64 mol·L-1·s-1时,则氧气减少的速率为________。
(3)如测得4 s后O2的浓度为2.8 mol·L-1,此时间内SO2的速率为0.4 mol·L-1·s-1,则开始时氧气的浓度为________。
【答案】研究反应物I-与S2O82-的浓度对反应速率的影响 29.3 化学反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比) SO2或O2 0.88 mol·L-1·s-1 5.0 mol·L-1
【解析】
I.(1)根据“题给反应的反应速率可以用加入的I3-使淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大”,实验设计了在相同温度下,不同的反应物浓度测定相应的反应时间,目的是探究反应物I-与S2O82-的浓度对反应速率的影响;综上所述,本题答案是:研究反应物I-与S2O82-的浓度对反应速率的影响 。
(2)通过分析各组数据知,反应物起始浓度的乘积与时间成反比,由①、⑤列比例式,可以解得t1:(0.040 molL-1×0.040molL-1):(0.120 molL-1×0.040molL-1)=t1:88.0s,解得t1=88/3=29.3s ;综上所述,本题答案是:29.3。
(3)通过第(1)、(2)小题的分析可知,结合表格中数据变化规律,我们已经知道了反应物的浓度乘积与时间成反比,而浓度的变化量与时间的比值为速率,显色时间越短,反应速率越快,所以根据本题的实验数据最终得到的结论为:反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比);综上所述,本题答案是:化学反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)。
II(1)只有气体或者溶液才有浓度的变化,固体或者纯液体的浓度是定值,故应选用SO2或O2来表示该反应的化学反应速率,因此,本题正确答案是: SO2或O2。
(2)v(SO2):v(O2)=8:11,故v(O2)=11/8×0.64=0.88 mol·L-1·s-1;综上所述,本题答案是:0.88 mol·L-1·s-1。
(3)c(SO2)=0.4×4=1.6mol/L,c(O2)=11/8c(SO2)=11/8×1.6=2.2 mol·L-1,故c(O2)=2.8+2.2=5.0 mol·L-1;综上所述,本题答案是:5.0 mol·L-1。


科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是
A. 在K2SO4与BaCl2两溶液反应时,增大压强
B. Fe与稀硫酸反应制取H2时,改用浓硫酸
C. Al在氧气中燃烧生成A12O3,将Al片改成Al粉
D. Na与水反应时增大水的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是
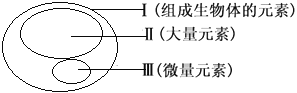
A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 溶液呈电中性,胶体带电荷。
B. 配制0.1 mol·L-1CuSO4溶液100 mL,称取1.6g硫酸铜晶体
C. 向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变
D. 制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
浓度(mol·L-1) | 体积(mL) | 浓度(mol·L-1) | 体积 (mL) | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥ ______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·min-1。
(4)已知实验③中c(MnO4—)~反应时间t的变化曲线如下图。若保其他条件不变,请在图中画出实验②中c(MnO4—)~t的变化曲线示意图。_______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
化学式:HCl
相对分子质量:36.5
密度约1.18 g·mL-1
HCl的质量分数:36.5%
(1)该盐酸中HCl的物质的量浓度=_____。
(2)取该盐酸50 mL加水稀释到100 mL,则稀释后溶液中c(HCl)=____。该实验选用的主要仪器有:烧杯、量筒、玻璃棒、和_________。
(3)该操作的正确顺序为_____(填序号)。
a.反复颠倒摇匀 b. 稀释浓盐酸c.用胶头滴管加水至刻度线 d.用量筒量取浓盐酸e.将配制好的溶液转入试剂瓶中贴上标签f.将溶液转入容量瓶
(4)下列情况对所配制的稀盐酸浓度有何影响?用“偏大”“偏小”或“无影响”填写。
a.所用的浓盐酸长时间放置在密封不好的容器中_____。
b.用量筒量取浓盐酸时,仰视刻度线_____。
c.洗涤量取过浓盐酸的量筒,并将洗液注入容量瓶中_____。
d.定容时俯视容量瓶的刻度线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法中正确的是
A. 4g甲烷完全燃烧转移的电子数为2NA
B. 11.2L(标准状况)CCl4中含有的共价键数为2NA
C. 3 mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D. 1L 0.1mol·L-1的Na2S溶液中HS-和S2-离子数之和为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是很好的净水剂,高铁酸钡( BaFeO4)是高能电池阳极的优良材料。已知:K2FeO4为紫色固体,微溶于KOH溶液,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定;在碱性溶液中,NaCl、NaNO3、K2FeO4的溶解性都小于Na2FeO4;BaFeO4难溶于水和碱性溶液。某化学兴趣小组欲制取“84”消毒液,进而制取少量K2FeO4和 BaFeO4。请回答下列问题:
(实验一)选择合适的仪器和试剂制取氯气,进而制备高浓度的“84”消毒液。

(1)选择合适的仪器,导管接口正确的连接顺序为___________;所选装置(A或B)中发生反应的离子方程式为______________________。
(实验二)用“84”消毒液制取K2FcO4
实验步骤:①用如图所示装置(夹持仪器略去)使反应物充分反应;②用砂芯漏斗对烧杯中的溶液进行抽滤,向滤液中慢慢加入KOH溶液;③再用砂芯漏斗对步骤②的最后反应混合物进行抽滤,并用苯、乙醚洗涤沉淀,真空干燥后得K2FeO4。

(2)写出步骤①中物质在20℃冷水浴中发生反应的化学方程式:______________________。
(3)步骤②中能够发生反应的原因是______________________,步骤③中不用水,而用苯、乙醚洗涤沉淀的目的是_________________________________。
(实验三)将上述产品配成K2FeO4碱性溶液,再慢慢加入Ba(OH)2溶液,抽滤得 BaFeO4。
(4)若投入ag硝酸铁晶体,得到bg高铁酸钡,则高铁酸钡的产率是___________。[已知Fe(NO3)3·9H2O的摩尔质量为404g·mol-1, BaFeO4的摩尔质量为257g·mol-1]
(实验四)利用如图所示电解装置也可以制得 BaFeO4。

(5)在___________(填“阳极区”或“阴极区”)可得到高铁酸钡,阳极的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com