
【题目】下列各项判断完全正确的是( )
选项 | 变化 | △H | △S | 方向性 |
A | H2O(l)→H2O(g) | >0 | <0 | 非自发 |
B | 2NO2(g) | <0 | <0 | 自发 |
C | NH4Cl(s)=NH3(g)+HCl(g) | <0 | >0 | 非自发 |
D | 2Fe3+(aq)+Cu(s)=2Fe2+(aq)+Cu2+ (aq) | >0 | <0 | 自发 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在水溶液中能离解为自由移动的离子的化合物是电解质
B. 强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物
C. CO2的水溶液导电能力很弱,所以CO2是弱电解质
D. 强电解质溶液导电性一定强于弱电解质的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:
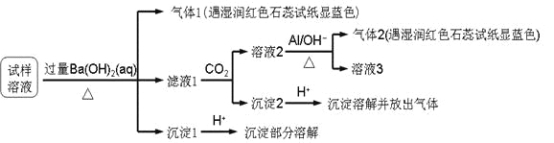
已知:3NO3-+ 8Al + 5OH-+ 18H2O = 3NH3+ 8[Al(OH)4]-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A. 试样中一定不含Al3+
B. 试样中肯定存在NH4+、Mg2+、SO42-和NO3-
C. 试样中可能存在Na+、Cl-
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是( )
A.碳酸钠可用于去除餐具的油污B.漂白粉可用于生活用水的消毒
C.碳酸钡可用于胃肠X射线造影D.氢氧化铝可用于中和过多胃酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. I- 遇淀粉变蓝色,I2易升华
B. 常温下单质溴为深红棕色液体,溴元素被称为海洋元素
C. 海水制溴,溶于水的溴可鼓入热空气或水蒸气吹出来
D. AgBr是重要的感光材料,AgI 可用于人工降雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
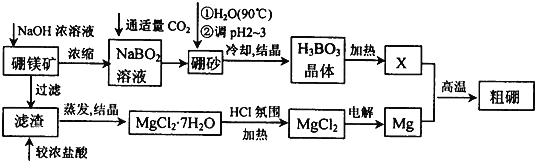
回答下列有关问题:
(1)将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为____________________________________。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是____________。
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+=Mg2++2H2O,则正极反应式为_____________________________。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为_____________(提示:I2+2S2O32-=2I-+S4O62-)(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物在现代工业和国防建设中具有十分重要的地位。金属锰的提炼方式主要有热还原法和电解法两种,热还原法得到的锰纯度在95-98%之间,电解法得到的锰(简称电解锰),其纯度可达99.7-99.9%以上。
(1)锰锌铁氧体是当前广泛使用的一种隐形涂料,其化学组成为MnxZn1-xFe2O4(铁为+3价),其中当锰锌铁氧体中n(Zn):n(Fe)=2:5时,它对雷达波的吸收能力最强。
① 锰锌铁氧体中锰元素的化合价为_______。
② 当雷达波吸收能力最强时,该物质的化学式为________(改写成氧化物的形式)。
(2)写出以MnO2和Al粉为原料,利用热还原法制备Mn的化学方程式:________.
(3)工业上以菱锰矿(主要成分是MnCO3,含有Fe2+、Co2+、Ni2+等杂质金属离子)为原料制备电解锰的流程图如下所示。
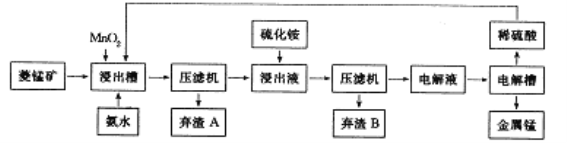
生成氢氧化物的pH如下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀时pH | 7.5 | 2.l | 7.7 | 7.6 | 8.3 |
完全沉淀时pH | 9.7 | 3.7 | 8.5 | 8.2 | 9.8 |
① 浸出槽中发生多个反应:如主要成分与硫酸的反应、MnO2与Fe2+间的氧化还原反应等,写出这两个反应的离子方程式:___________________、____________________。
② 加入氨水的目的是为除去杂质,根据流程图及表中数据,pH 应调控在_____范围内。常温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=4时溶液中c(Fe3+)=__________。
③ 加入硫化铵是为除去剩余的Ni2+,反应的离子方程式为____________________。
④ 写出电解硫酸锰溶液制取金属锰的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小雨对爸爸给患病的奶奶购买的“便携式制氧器”(图1)产生浓厚的兴趣,他仔细阅读使用说明书,了解了它的工作原理(如图2)和所用的药品.药品中甲剂是一种白色颗粒状固体,作制氧剂;乙剂是黑色固体,作催化剂. 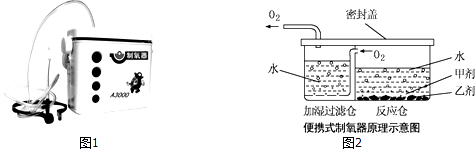
【提出问题】甲剂的化学成分是什么?
【阅资料】过碳酸钠是白色颗粒状固体,溶于水时,生成碳酸钠和过氧化氢,可用于制取氧气.
【设计与实验】小雨把甲剂和乙剂带到实验室与黄老师共同探究.在老师的指导下,验证出甲剂是一种钠盐后,小雨接着进行如下实验:
[实验一]用甲剂和乙剂制取并验证氧气.
(1)根据图2得出:组装气体发生装置时应选择图3所示的仪器:(填字母),该装置还可用于制取的气体是; 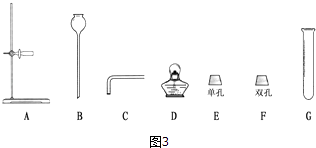
(2)装置连接完毕,装药品前应先检查装置的;
(3)小雨认为氧气是由过氧化氢在乙剂催化下产生的,其化学方程式为;
(4)检验氧气的方法是 . [实验二]检验上述反应后的溶液中是否含有碳酸根离子.
检验步骤 | 实验操作 | 实验现象 | 结论 | |
步骤一 | 取少量反应后的溶液,加入稀盐酸 | 有气泡产生 | ||
步骤二 | 将步骤一产生的气体通入澄清石灰水 | 澄清石灰水变浑浊 |
(5)【实验结论】通过上述实验,小雨得出甲剂是过碳酸钠. 【反思与评价】小方认为小雨的结论不够严密,你认为严密的结论应该是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com