
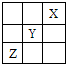
 短周期元素X、Y、Z在周期表中的位置关系如图所示,下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,下列叙述中正确的是( )| A、Z的最高化合价为+6价 |
| B、X的最高价氧化物的水化物是一种强酸 |
| C、1molY的单质跟足量水反应时,发生转移的电子为1mol |
| D、Z一定是活泼金属元素 |


科目:高中化学 来源: 题型:
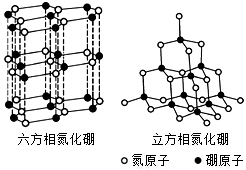 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 样品起始质量-a点固体质量 |
| 样品起始质量 |
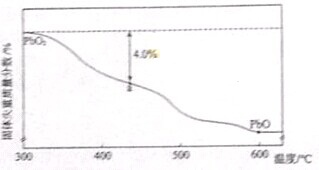
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊是易导电的银白色金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、能生成+3价离子化合物 |
| D、Tl3+的氧化能力比Al3+强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
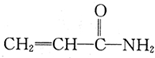 .下列相关分析正确的是( )
.下列相关分析正确的是( )| A、电负性:C<N<O |
| B、该分子中σ键与π键数目之比为4:2 |
| C、该分子所有原子处于同一平面 |
D、该分子的加聚产物为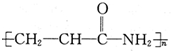 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定没有CO2,肯定有H2 |
| B、一定有CO、CO2和水蒸气? |
| C、一定有H2、CO2和HCl |
| D、可能有CO2、NH3和水蒸气? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素A | 元素B | 元素C | 元素X | 元素Y | 元素Z |
| 单质是一种常见金属,与元 素X形成黑色和红棕色三种常见化合物 |
单质是一种黄绿色气体 | 短周期中金属性最强,与X 反应能生成两种常见化合物 |
最外层电子数是内层电子数的3倍,能形 成双原子阴离子 |
单质为双原子分子,结构中б键与π键数 目比为1:2 |
阳离子就是一个质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com