
①2X+O2=
上述方程式中除氧气外的其他物质均为氧化物,且通常状况下X、Y、Z都是气体,请根据要求回答问题:
(1)如果反应①在常温常压下即可顺利进行,则M的化学式是__________________________。
(2)如果反应②是一个燃烧反应,则Q的电子式是____________________,其分子为_________ (填“极性分子”或“非极性分子”)。
(3)如果反应③需在催化剂存在并加热条件下进行,则Z的化学式是___________________,其固体的晶体类型为_________。
Ⅱ.(4)将
(5)取
Ⅲ.(6)反应①—⑤是氧化还原反应,但其中一个的化合价升降与另外四个有明显不同,请你找出这个反应:_________ (填序号),你作此选择的理由是___________________________。
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
①2X+O2====2M ②2Y+O2====2Q ③2Z+O2====2R
上述方程式中除氧气外的其他物质均为氧化物,且通常状况下X、Y、Z都是气体,请根据要求回答问题:
(1)如果反应①在常温常压下即可顺利进行,则M的化学式是________________。
(2)如果反应②是一个燃烧反应,则Q的电子式是________,其分子为________(填“极性分子”或“非极性分子”)。
(3)如果反应③需在催化剂存在并加热条件下进行,则Z的化学式是____________,其固体的晶体类型为________________。
Ⅱ.(4)将6.2 g Na2O在干燥而充足的氧气中加热,充分反应;冷却后称量,固体质量为7.8 g,则该反应(反应④)的化学方程式为______________________________________。
(5)取43.2 g FeO在空气中充分加热,冷却后称量发现质量增加3.2 g,则该反应(反应⑤)的化学方程式为_______________________________________________________________。
Ⅲ.(6)反应①—⑤是氧化还原反应,但其中一个的化合价升降与另外四个有明显不同,请你找出这个反应:________________(填序号),你做此选择的理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸、硫酸和硝酸是中学阶段常见的三种酸。请就三种酸与金属铜反应的情况,回答下列问题。
⑴稀盐酸与同不反应,A同学设想不添加其他试剂,而是设计一个装置来实现以下反应:Cu + 2HCl === CuCl2 + H2↑ 请你画出该装置的示意图。
⑵在100 mL 18 mol·L-'的浓硫酸中加入过量的铜片,加热使之充分反应,得到的气体的物质的量________(填“﹤”、“﹥”或“=”)0.9mol。该反应的化学方程式是________________。
B同学提出,可向反应后的混合物中加入硝酸盐,使剩余的铜片继续溶解,请写出反应的离子方程式:________________________________________________。
(3)W g Cu与V mL过量的浓硝酸反应所得溶液呈绿色。W g Cu与V mL 过量的稀硝酸反应所得溶液呈蓝色。对于溶液颜色的不同,C同学提出可能是Cu2+浓度不同引起的。你是否赞同? _______(填“是”或“否”),理由是_______________________。
D同学认为Cu2+在溶液中应该是蓝色的,绿色是由于生成的NO2与Cu2+共存造成的,请您设计一个实验来检验D同学的假设。写出实验的操作,现象和结论:________________。
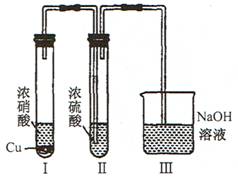
(4)E同学为探究浓硫酸能否作为NO2气体的干燥剂,设计了如图所示的实验,观察到:Ⅱ中溶液变为红棕色,且未有气体逸出。你得出的结论是:__________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京二中高三(上)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com