
����Ŀ���������������������������Ҫԭ��֮һ���������������ж��ַ�����
��1�������ü������ԭ���������֪��
CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g) ��H����574kJ/mol
CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g) ��H����1160kJ/mol
��CH4(g)��NO2(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ�� ��
��2��NH3����ԭ����������SCR)������ĿǰӦ����㷺���������������ѳ������������Ļ�ѧ��Ӧ�ǣ�2NH3(g)��NO(g)��NO2(g)![]() 2N2(g)��3H2O(g)��H<0��Ϊ��ߵ��������ת���ʿɲ�ȡ�Ĵ�ʩ�ǣ�һ�����ɣ� ��
2N2(g)��3H2O(g)��H<0��Ϊ��ߵ��������ת���ʿɲ�ȡ�Ĵ�ʩ�ǣ�һ�����ɣ� ��
��3������β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)����H��0
2CO2(g)+N2(g)����H��0
�ٸ÷�Ӧƽ�ⳣ������ʽ
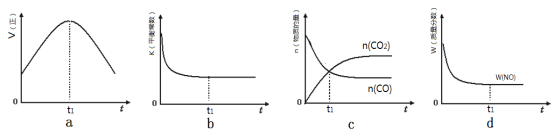
�����÷�Ӧ���������������ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���� ������ţ���
��4������ClO2�����������ﷴӦ�������£�![]()
��Ӧ��Ļ�ѧ����ʽ��2NO+ClO2+H2O===NO2+HNO3+2HCl����Ӧ��Ļ�ѧ����ʽ�ǡ�����11.2LN2���ɣ���״������������ClO2 g��
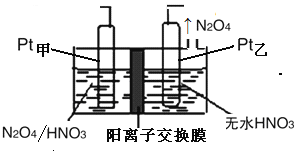
��5����ҵ�����к��е�NO2�����õ�ⷨ��������NO2Ϊԭ�Ͽ���������ɫ������N2O5���Ʊ�����֮һ���Ƚ�NO2ת��ΪN2O4Ȼ����õ�ⷨ�Ʊ�N2O5��װ������ͼ��ʾ��Pt��Ϊ�ĵ缫��Ӧʽ�� ��
���𰸡���1��CH4(g)��2NO2(g)��N2(g)��CO2(g)��2H2O(g)��H����867kJ/mol
��2������NH3Ũ�ȣ���ѹǿ�������¶ȣ�
��3����![]() ��bd
��bd
��4��2NO2+4Na2SO3��N2+4Na2SO4��67.5
��5��N2O4+2HNO3��2e����2N2O5+2H+
��������
�����������1����֪����CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g)��H����574kJ/mol
��CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g)��H����1160kJ/mol
����ݸ�˹���ɿ�֪����+�ڣ�/2���õ�CH4(g)��NO2(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ��CH4(g)��2NO2(g)��N2(g)��CO2(g)��2H2O(g)��H����867kJ/mol��
��2����ѧ��Ӧ��2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O���������������ķ��ȷ�Ӧ�����NOx��ת������ƽ�������ƶ�������Բ�ȡ�Ĵ�ʩ������NH3Ũ������ѹǿ�������¶�����
2N2(g)+3H2O���������������ķ��ȷ�Ӧ�����NOx��ת������ƽ�������ƶ�������Բ�ȡ�Ĵ�ʩ������NH3Ũ������ѹǿ�������¶�����
��3���ٻ�ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����ݷ���ʽ��֪�÷�Ӧƽ�ⳣ������ʽ![]() ��
��
��a��t1ʱ����Ӧ������Ȼ�ڱ仯��˵��û�дﵽƽ��״̬��a����B��t1ʱƽ�ⳣ�����ٱ仯�����淴Ӧ������ȣ�˵���ﵽ��ƽ��״̬��b��ȷ��C��t1ʱ������̼��һ�����������ʵ������ڱ仯��˵�����淴Ӧ���ʲ���ȣ���Ӧû�дﵽƽ��״̬��c����D��t1ʱһ�������������������ٱ仯���������淴Ӧ������ȣ��ﵽ��ƽ��״̬��d��ȷ����ѡbd��
��3����Ӧ�����������Ʊ�����Ϊ�����ƣ�ͬʱ������������Ӧ�Ļ�ѧ����ʽ��2NO2+4Na2SO3��N2+4Na2SO4�����ݷ�Ӧ�ķ���ʽ��֪ת����ϵʽ�У�2ClO2��2NO2��N2��n(ClO2)=2n(NO2)=1mol��m(ClO2)=67.5g��
��5��Pt�缫�Ҳ���N2O4��˵����������õ����ӣ���������������Pt�缫����������N2O4ʧȥ����ת��ΪN2O5���缫��ӦʽΪN2O4+2HNO3��2e����2N2O5+2H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ��� ��
�� Cl���Ľṹʾ��ͼ![]()
�� �ǻ��ĵ���ʽ��![]()
�� HClO�Ľṹʽ��H��Cl��O
�� NaHCO3��ˮ�еĵ��뷽��ʽ��NaHCO3=Na����H����CO32-
�� Na2O��ˮ��Һ�ܵ������ⲻ��˵��Na2O�ǵ����
�� SiO2����������ᷴӦ������NaOH��Һ��Ӧ����SiO2�����������
�� �������ѻ����ǻ�ѧ�仯�� ��
A���٢ڢ� B���٢ܢޢ� C���ڢۢܢ� D���ڢۢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �ʱ���ָ1 mol���ʲμӷ�Ӧʱ�������仯
B. ����Ӧ����ʱ��H>0����Ӧ����ʱ��H<0
C. �ڼ��������·����ķ�Ӧ��Ϊ���ȷ�Ӧ
D. һ����ѧ��Ӧ�У�����Ӧ��������������������������ʱ����Ӧ���ȣ���HΪ��ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪij�ӵ��α�ǩ��һ���֡�

��֪����KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
��I2+2Na2S2O3=2NaI+Na2S4O6����ɫ��
ijͬѧ�붨���ⶨ�˼ӵ����е�Ԫ�صĺ�������������ʵ����
����1����ȡag����ʳ�Σ������Һ��ȫ��ת������ƿ�У�������������KI��Һ�����뼸��ϡ���ᣬ��Һ���ɫ���ټ���3�ε�����Һ��
����2��ȡһ֧50mL��ʽ�ζ��ܣ���bmol��L-1������Na2S2O3 ��Һ��ϴ2��3�κ�װ����Һ������Һ��߶���0�̶ȡ�
����3����ʼ�ζ�ֱ���յ㣬�ظ�����2��3�Σ�ʵ�����ݼ�¼���£�

��1����һ�ζ���Ϊ mL��
��2���ζ��յ���жϷ��� ��
��3���������㣬�˵�����Ԫ���ĺ���Ϊ mg��kg-1���ú�a��b��������ʽ��ʾ�� ��
��4�����в������ܻᵼ�²������ƫ�͵��� ��
A������1�г�ȡʳ��ʱ������������̣�ʳ�η��ڷ������̣��������Ϊ0.5g
B������1����ʳ����Һδ��ȫת������ƿ
C������2�еζ���ϴ�Ӻ�δ��ϴ
D������3�ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ���������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��Һ���ܴ��������һ�������ǣ� ��
A.Fe2+��Al3+��ClO����Cl��
B.K+��Cu2+��OH����NO3��
C.NH4+��Na+��Br����SO42��
D.Mg2+��H+��SiO32����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵ�ȼ������ȵ���
A. 1 mol C��2 mol CO
B. 1 mol C��3 mol C
C. 3 mol C2H2��1 mol C6H6
D. 1 mol���ۺ�1 mol��ά��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����зǼ��Լ��Ĺ��ۻ������ǣ� ��
A.Na2O2
B.CH3CH3
C.NaCl
D.N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����λͬѧ�ֱ�����������ʵ��װ�ü���ѧҩƷ�����м�ʯ��Ϊ�����������ƺ���ʯ�ҵĻ�����ȡ����������ش��������⣺
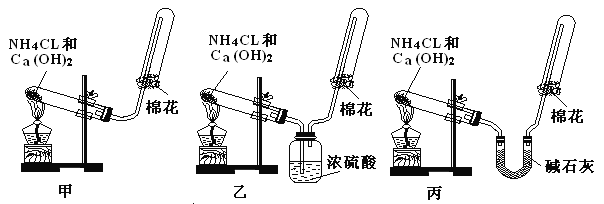
��1����λͬѧ��ȡ�����Ļ�ѧ����ʽΪ��___________________��
��2����λͬѧ���������ſ������ռ���������ԭ����_____________________��
��3����λͬѧ������װ����ȡ����ʱ��������һλͬѧû���ռ�������������ǵ�ʵ���������ȷ��������Ϊû���ռ���������ͬѧ��_______ ����ס������ҡ����������ռ�������������Ҫԭ����_________________���û�ѧ����ʽ��ʾ����
��4�����鰱���Ƿ��ռ����ķ����ǣ�������������������ͽ��ۣ�__________________��
��5����λͬѧ����Ϊ���ǵ�ʵ��װ��Ҳ�����ڼ���̼����粒�����ȡ�����İ��������ж��ܹ��ﵽʵ��Ŀ�ĵ���_______ ����ס������ҡ�����������װ���е�NH4HCO3�����ܷ���NH4Cl������棿_______ ����ܡ����ܡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����еķ�Ӧ������ͬһ��Ӧ���͵���
A. ����������������飺��ϩ���Ȼ��ⷴӦ��������
B. �Ҵ�����ϩ������������Ӧ
C. ������ϡ���Ṳ�ȣ����������ƻ�����
D. �Ҵ�����������ȩ�������������Ƶ�������ͭ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com