
【题目】35Cl和 35Cl- 两种微粒中,不同的是
A. 核内质子数 B. 核外电子层数 C. 核内中子数 D. 核外电子数
科目:高中化学 来源: 题型:
【题目】25℃时,有下列四种溶液,下列说法正确的是
① | ② | ③ | ④ |
0.1mol/L的氨水 | pH=11的氨水 | 0.1mol/L的盐酸 | pH=3的盐酸 |
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都成酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值变小
的值变小
D. 将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则c(NH4+)>c(Cl-)> c(NH3H2O)> c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式____________。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是______________;
②写出Al2Cl6分子的结构式_______________;
③单分子A1Cl3的立体构型是__________,缔合双分子Al2Cl6中Al原子的轨道杂化类型是_______。
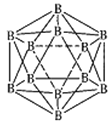
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有____________种不同的结构类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm3,计算确定其晶胞的类型(简单、体心或面心立方)________________;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=______________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中先后发生甲、乙两个反应,实现了I-与IO-之间的转化,请依次写出发生反应的离子方程式,反应甲:______________;反应乙:____________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图_______。

II.(2)Fe2+与Ag+在溶液中可以发生氧化还原反应。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如图所示:
①用离子方程式表示Fe(NO3)2溶液中发生的反应___________________________________。
②据A点数据,计算该转化反应的平衡常数为____________________。
③用下图的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是__________________。石墨为电池的_____极,通过列式计算说明原因_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下。下列说法正确的是

A. a电极为太阳能电池的正极
B. 产生丙烯的电极反应式为:3CO2+18H++18e-===CH3CH=CH2+6H2O
C. 装置中每转移2e-,理论上有2molH+通过质子交换膜从左向右扩散
D. 太阳能电池的原理与原电池的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________。
Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

(2) “酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4生成1molPbSO4转移电子的物质的量为____________mol。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示:
NaHPbO2(aq),其溶解度曲线如图所示:

②粗品PbO中所含杂质不溶于NaOH溶液。
结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量__________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,___________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl2的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。

①阴极的电极反应式为_______________________。
②电解一段时间后,Na2PbCl4浓度极大减小,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铁溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是
A. Fe(OH)3 Fe2O3 B. Fe(OH)2 Fe2O3
C. Fe(OH)2 Fe(OH)3 D. Fe(OH)2 Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(沸点65℃)是一种可再生能源,具有广泛的开发和应用前景。
(1)常温下,1g甲醇完全燃烧生成液态水时放出22.7kJ的热量,写出表示甲醇燃烧热的热化学方程式 ________________________________________________。
(2)现有反应CO(g)+2H2(g) =CH3OH(g)过程中能量变化如图所示,写出该反应的热化学方程式_______________________________;

该反应在不同温度下的化学平衡常数 K(250℃)____K(350℃)(填“大于”或“小于”),
若恒温恒容下,将3molCO和6molH2充入密闭容器中进行该反应,反应达到平衡,测得容器内压强为开始时的0.6倍,CO的转化率为_______。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH- =2CO32-+6H2O,则负极的电极反应式为:________________________。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:_____________;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH-物质的量浓度为0.01 molL-1(25℃下测定),则理论上消耗氧气的体积为_________mL(标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
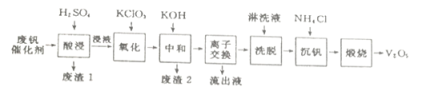
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过査阅资料找到一种废钒催化剂的回收工艺流程路线如下:
可答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则V2O5转化为VO2+ 的离子方程式为______________。 “废渣1”的主要成分是_______。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式_______________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有_____________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH 为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是___________;为了提高洗脱效率,淋洗液应该呈____________性(填“酸”、“碱”或“中”)。
R4V4O12+4OH-(ROH 为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是___________;为了提高洗脱效率,淋洗液应该呈____________性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉淀的化学方程式__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com