
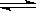 XC(g)符合如图像(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
XC(g)符合如图像(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )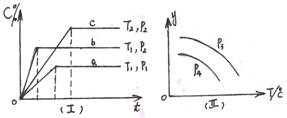

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3(g) △H<0,下列研究目的与示意图相符的是
2NH3(g) △H<0,下列研究目的与示意图相符的是| | A | B | C | D |
| 研究目的 | 压强对反应的影响(P2<P1) | 温度对反应的影响 | 恒温恒容时,向平衡中增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 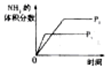 | 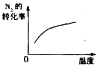 | 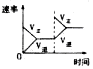 | 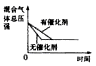 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O (g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O (g)的浓度随时间变化如图所示。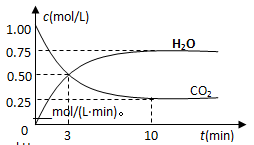
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由H2、I2、HI组成的平衡体系加压后颜色变深 |
| B.黄绿色的氯水光照后颜色变浅 |
| C.使用催化剂可加快SO2转化为SO3的速率 |
| D.将木炭粉碎后与O2反应,速率更快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)的下列叙述中,能说明反应已达到平衡的是( )
2C(g)的下列叙述中,能说明反应已达到平衡的是( )| A.单位时间内消耗amolA,同时生成2amolC |
| B.C生成的速率与C的分解速率相等 |
| C.若容器体积不变,容器内的压强不再变化 |
| D.混合气体的物质的量不再变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见表。下列说法正确的是
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见表。下列说法正确的是 | 温度 | 平衡浓度/ (mol L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | | 0.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L 。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L 。 2SO3(g) ΔH =" -" 196.6 kJ· mol-1
2SO3(g) ΔH =" -" 196.6 kJ· mol-1 2NO2(g) ΔH =" -" 113.0 kJ· mol-1
2NO2(g) ΔH =" -" 113.0 kJ· mol-1 SO3(g)+NO(g)的ΔH = kJ· mol-1。
SO3(g)+NO(g)的ΔH = kJ· mol-1。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com