
【题目】SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是

A. 电子流动方向为:B→b→a→A
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极上的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
【答案】C
【解析】根据图示可知,SO2→H2SO4,硫元素化合价升高,发生氧化反应,所以B为电解池的阳极,A为电解池的阴极,a为电源的负极;电子由负极流向正极,因此电子流动方向为a→A→B→b,A错误;a为电源的负极,发生氧化反应,A为电解池的阴极,发生还原反应,B错误;该电解池中阴极发生还原反应:2SO32-+2e-+ 4H+ =S2O42-+ 2H2O,阳极发生氧化反应:SO2-2e-+2H2O ===4H++SO42-,反应需要氢离子,因此离子交换膜为阳离子交换膜,C正确;B为电解池的阳极,失电子:SO2-2e-+2H2O ===4H++SO42-,D错误;正确选项C。


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
浓度c/mol/L | 0.1 | 0.1 | 0.1 | 0.1 |
溶液 | 氨水 | CH3COONa溶液 | 醋酸 | 盐酸 |
A.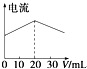 在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如图
在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如图
B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO﹣)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
D.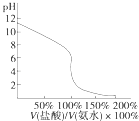 用④滴定①,滴定曲线如图,可用酚酞作指示剂
用④滴定①,滴定曲线如图,可用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现:
①Si(s) +3HCl(g)![]() SiHCl3(g) + H2(g) △H= -381kJ/mol
SiHCl3(g) + H2(g) △H= -381kJ/mol
②SiHCl3(g)+H2(g)![]() S(s) + 3HCl(g)
S(s) + 3HCl(g)
对上述两个反应的下列叙述中,不正确的是
A. 两个反应都是置换反应 B. 反应②是吸热反应
C. 两个反应互为可逆反应 D. 两个反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯,简称SM,是石化行业的重要基础原料,主要用于生产苯乙烯系列树脂及丁苯橡胶。苯乙烯能发生如下一系列变化。下列说法不正确的是
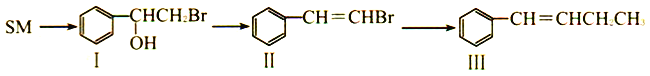
A. 有机物SM能使溴的四氯化碳溶液褪色
B. 有机物I能与金属钠反应放出H2
C. 有机物I、II均能发生氧化反应和加成反应
D. 有机物I的同分异构体中,苯环上只有一个烃基且含有碳碳双键的结构有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)( )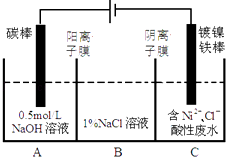
A.碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O
B.为了提高Ni的产率,电解过程中需要控制废水pH
C.电解过程中,B中NaCl溶液的物质的量浓度将不断减小
D.若将图中阳离子膜去掉,将
A.B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,,8.0DgCH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写山该反应的热化学反应方程式:____________________。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。
在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
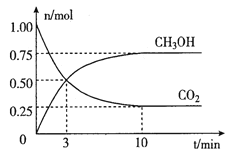
①从反或开始到平衡,CO2的平均反应速率v(CO2)=____。
②达到平衡时,H2的转化率为__________。
③下列措施不能提高反应速率的是__________。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1mclCH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
B. 17gH2O2所含非极性键数目为0.5NA
C. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
D. 56g铁与足量氯气反应,氯气共得到3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= , 已知:K(300℃)>K(350℃),该反应是反应(填“放热”或“吸热”).
(2)图中表示NO2的变化的曲线是 , 用O2的浓度变化表示从0~2s内该反应的平均速率v= . 
(3)能说明该反应已经达到平衡状态的是 a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com