
����Ŀ�����й��ڻ�ʯȼ�ϼ���ʹ�õ�һЩ˵���в���ȷ����(����)
A. ú��������ָ����̬ú���������±�Ϊ��̬����ʹúȼ��ʱ����������ֽӴ�����ȫȼ��
B. ��Ȼ���������������Դ�⣬Ҳ�����ںϳɰ��������״���
C. ʯ�ͷ���õ������ͺ�ʯ�ʹ��ѻ��õ���������ɷֲ���ͬ
D. ��ʯȼ��Ҳ����Ҫ�Ļ���ԭ�ϣ���ϩ�ͱ����Ƿֱ�������ʯ�ͺ�ú�Ļ�������ԭ��
���𰸡�A
��������
A��ú��������ָ������úת��Ϊ����CO��H2��CH4�ȿ�ȼ�����CO2��N2�ȷǿ�ȼ����Ĺ��̣�
B����Ȼ����һ�ֹ��ϵ���ࡢ��Ч����ɫ��Դ��
C��ʯ�ͷ���õ���������Ҫ���б�������ʯ�ʹ��ѻ��õ������ͺ��в���������
D��ʯ���ѽ���Եõ���ϩ�����������Եõ�����
A��ú�������ǽ���̬úת��Ϊ��ȼ������Ĺ��̣���Ҫ��Ӧ�Ļ�ѧ����ʽΪC(s)��H2O(g) ![]() CO(g)��H2(g)��ѡ��A����
CO(g)��H2(g)��ѡ��A����
B����Ȼ����ú��ʯ�Ͷ�����Ҫ�Ļ���ԭ�ϣ�ѡ��B��ȷ��
C��ֱ�����͵ijɷ����������ѻ������к��в���������ѡ��C��ȷ��
D����Ȼ����ú��ʯ�Ͷ�����Ҫ�Ļ���ԭ�ϣ�ѡ��D��ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4����һ�ּ�������������������һ������Ͷ��ˮ���������������������£�
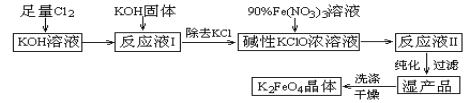
��֪��
��2KOH + Cl2 = KCl + KClO + H2O���������¶Ƚϵͣ�
��6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O���������¶Ƚϸߣ�
��2Fe��NO3��3 + 3KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
�ش��������⣺
��1������������Ӧ��______________����¶Ƚϸߡ����¶Ƚϵ͡�������½��У�����ɫ��ѧ�ĽǶȿ���ͨ����������Ӧ________����Ͽ족����������
��2��д����ҵ����ȡCl2�Ļ�ѧ����ʽ_____________________________________��
��3��K2 FeO4����Ϊ���Ͷ��ˮ��������ԭ����______________________��
��4������KOH��Һʱ������ÿ100 mLˮ���ܽ�61��6 g KOH���壨����Һ���ܶ�Ϊ1��47 g/mL�����������ʵ���Ũ��Ϊ____________��������������
��5���ڡ���ӦҺI���м�KOH�����Ŀ����__________��
A���롰��ӦҺI���й�����Cl2������Ӧ�����ɸ����KClO
B��KOH�����ܽ�ʱ��ų��϶����������������߷�Ӧ����
C��Ϊ��һ����Ӧ�ṩ��Ӧ��
D��ʹ������KClO3ת��Ϊ KClO
��6���ӡ���ӦҺII���з����K2FeO4���и���Ʒ_____________��д��ѧʽ����
��7���ù���ÿ�õ�1.98 kg K2FeO4������������Cl2�����ʵ���Ϊ___________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ���ʽṹ�Ļ�ѧ�����ģ��ͼ��ȷ����
A. H2O2�ĵ���ʽ��![]()
B. CO2�ı���ģ��: ![]()
C. ������ӵı���ģ��ʾ��ͼ��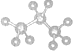
D. ������Ca2Mg3Si8O22(OH)2������������ʽ��ʾΪ��2CaO5MgO��8SiO2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ������£�
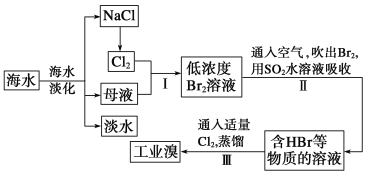
��1�����оٺ�ˮ���������ַ�����__________________________��__________________________��
��2�����������ѻ��Br2�����������ֽ�Br2��ԭΪBr������Ŀ����__________________________��
��3����������SO2ˮ��Һ����Br2�������ʿɴ�95%���йط�Ӧ�Ļ�ѧ����ʽΪ_________________�� �ɴ˷�Ӧ��֪�������������⣬�ڹ�ҵ������Ӧ�������Ҫ������__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽�����������ķֽ�������������ͼװ����ʾ��ʵ�飬��K1��K2������ͨ��N2��һ��ʱ�����ȣ�ʵ���Ӧ���в�������Ϊ��ɫ��ĩ��BaCl2��Һ���а�ɫ����������Ʒ����Һ�к�ɫ��ȥ���������������Һ���ڴ�����������������˵���������
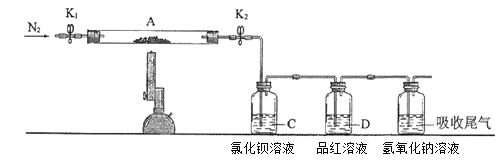
A. ����������Һ�����������ն����SO2����
B. ��Ӧ���ڲ����ĺ�ɫ��ĩ������Fe2O3
C. BaCl2��Һ��Ŀ���Ǽ���SO3�Ĵ���,�˴���Ba(NO3)2��ҺҲ���Լ���SO3
D. ��Ӧ���ڵõ�����������ͻ�ԭ�������ʵ���֮��Ϊ1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������̼���о�һֱ�ǿƼ����ע���ص㡣
I���ڴ�����������H2��ԭCO2�ǽ������ЧӦ����Ҫ�ֶ�֮һ����ط�Ӧ���£�
����Ӧ��CO2(g)+4H2(g)=CH4(g)+2H2O(g) ��H1��
����Ӧ��CO2(g)+H2(g)=CO(g)+H2O(g) ��H2=+41.2kJ/mol
��֪H2��CH4��ȼ���ȷֱ�Ϊ-285.5kJ��mol-1��-890.0kJ��mol-1
H2O(l)=H2O(g) ��H=��44 kJ��mol-1
��1����H1=______kJ��mo l-1��
��2�����������CH4ƽ����ʵķ�Ӧ�����ǣ�����д������_________����ҵ������鷴Ӧѡ���ԵĹؼ�������_____________��
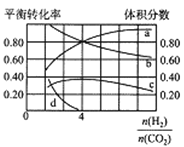
��3��T��ʱ�����������Ϊ2L���ܱ�������ͬʱ����������Ӧ�������ʵ���֮��Ϊ5mol��H2��CO2�Բ�ͬ��Ͷ�ϱȽ��з�Ӧ�������ͼ��ʾ����a��b��ʾ��Ӧ���ת���ʣ����ʾH2ת���ʵ���______��c��d�ֱ��ʾCH4(g)��CO(g)�������������ͼ��֪![]() =______ʱ�����������ߡ�����������CO�IJ�������0����T��ʱ�ٵ�ƽ�ⳣ��K=________��
=______ʱ�����������ߡ�����������CO�IJ�������0����T��ʱ�ٵ�ƽ�ⳣ��K=________��
II.���ں�ˮ��CO295%��HCO3-��ʽ���ڡ��ں����У�ͨ��������ͼ�ƻ�����ʵ��̼�Ծ���
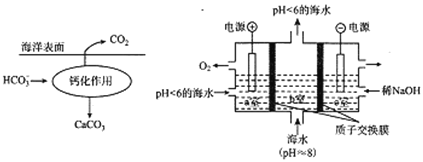
��4��д��д���ƻ����õ����ӷ���ʽ____________��
��5�������ɺ�a�ҵ�pHֵ______�����������С���������䡱)�����b�ҷ�����Ӧ�����ӷ���ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʷ�����ȷ����( )
�� | �� | �� | ������ | |
A | �� �� | �� �� | ��ʯ�� | �� �� |
B | ������ | �� �� | �� �� | ��ʯ�� |
C | ̼ �� | �մ� | С�մ� | �������� |
D | ������̼ | ������ | ʳ �� | ʯ��ʯ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2 mol B��������2L���ܱ������У���Ϻ������·�Ӧ��2A(g)+ B(g) = 2C(g)������2 s����C��Ũ��Ϊ1.2 mol/L������˵����ȷ��
A. ������A��ʾ�ķ�Ӧ����Ϊ1. 2 mol / (L s)
B. ������B��ʾ�ķ�Ӧ����Ϊ0. 3 mol / (L s)
C. 2 sʱ����A��ת����Ϊ30%
D. 2 sʱ����B��Ũ��Ϊ0.6 mol / L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬŨ�ȣ�c)���¶ȣ�T)������������ˮ���˲ʱ���ʣ�v�����±��������жϲ���ȷ����
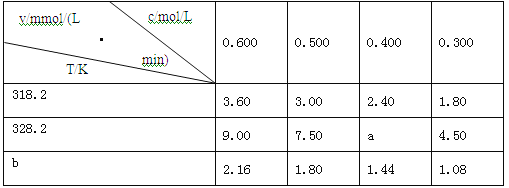
A��a=6.00
B��ͬʱ�ı䷴Ӧ�¶Ⱥ����ǵ�Ũ�ȣ�v���ܲ���
C��b��318.2
D����ͬ�¶�ʱ������Ũ�ȼ���һ�������ʱ����ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com