
����Ŀ��������(��Ҫ�ɷ�ΪAl2O3��������SiO2��Fe2O3)�ǹ�ҵ���Ʊ�����������Ҫԭ�ϣ���ҵ����ȡ�������Ĺ����������£�
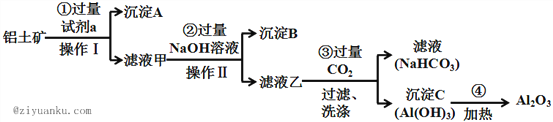
(1)����A�ijɷ��ǣ��ѧʽ��_________��
(2) ������м������NaOH��Һ������Ӧ�����ӷ���ʽ������H++OH��=H2O������
_____________________________��________________________________��
(3) �������ͨ�����CO2�������������������������___________________��
(4) ȷ��ȡ8g��������Ʒ������һ�����Լ�a����Һ��ʹ���е�Al2O3��Fe2O3ǡ���ܽ���Ȼ��������Һ�м���10mol��L��1��NaOH��Һ���������������������NaOH��Һ�������ϵ��ͼ��ʾ������Ʒ��Al2O3�İٷֺ���Ϊ_________��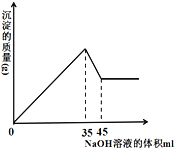
���𰸡� SiO2 Fe3++3OH��=Fe(OH)3 Al3++4OH��=[Al(OH)4]�� ����������ʹ���ɵ�Al(OH)3�ܽ� 63.75%
���������������м�������Լ�a��Ȼ�����I�õ�����A����Һ�ף������IΪ���ˣ���Һ���м������NaOH��Һ����II��õ�����B����Һ�ң�����II�ǹ��ˣ�Al2O3��SiO2������ǿ����Һ��Fe2O3������ǿ����Һ��SiO2������ϡ�����Fe2O3��Al2O3������ϡ���ᣬ����ͼ֪����Һ���к�����Ԫ�أ����Լ�aΪϡ���ᣬ����AΪSiO2����Һ��������Ϊ�Ȼ������Ȼ�����HCl������BΪFe(OH)3����Һ���к���NaAlO2��NaOH��NaCl������Һ����ͨ����˶�����̼�õ���Һ̼��������Һ������CΪAl(OH)3���������������õ���������
(1)ͨ�����Ϸ���֪������A SiO2���ʴ�Ϊ��SiO2 ��
(2)������м������NaOH��Һ��ϡ���ᡢ�����ӡ������Ӷ���NaOH��Һ��Ӧ��������Ӧ�����ӷ���ʽ��H++OH-=H2O��Fe3++3OH-=Fe(OH)3����Al3++4OH-=[Al(OH)4]-���ʴ�Ϊ��Fe3++3OH-=Fe(OH)3����Al3++4OH-=[Al(OH)4]-��
(3)�������ͨ�����CO2������������������������ǹ�����ϡ�������ܽ����ɵ������������ò��������������ʴ�Ϊ������������ʹ���ɵ�Al(OH)3�ܽ⣻
(4)����ͼ֪��35-45mLNaOH��Һ���ܽ�Al(OH)3���ܽ�Al(OH)3����NaOH���������Al(OH)3����NaOH��Һ�����![]() ����������Al(OH)3����NaOH��Һ���Ϊ30mL��35mLNaOH��Һʱ�����ӡ���������ȫ����������������������������NaOH��Һ���Ϊ5mL��
����������Al(OH)3����NaOH��Һ���Ϊ30mL��35mLNaOH��Һʱ�����ӡ���������ȫ����������������������������NaOH��Һ���Ϊ5mL��
���ݹ�ϵʽAl2O3��2Al(OH)3��6NaOH֪��n(Al2O3)= ![]() =0.05mol��m(Al2O3)=0.05mol��102g/mol=5.1g����������������=
=0.05mol��m(Al2O3)=0.05mol��102g/mol=5.1g����������������=![]() ��100%=63.75%���ʴ�Ϊ��63.75%��
��100%=63.75%���ʴ�Ϊ��63.75%��


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�������-3������Ĵ����ܹ�����һ�������Դʹ�á����й���32He��˵����ȷ����
A. 32Heԭ�Ӻ��ں���3������ B. 32He��3 1H��Ϊͬλ��
C. 32Heԭ�Ӻ�����3������ D. 32He��42He�����ֲ�ͬ�ĺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������� (����)��
A�����������Բ�����ά����ǿ�塢�ϳ���֬������ĸ��ϲ���
B���ɻ�����������Խ���Ϊ��ǿ�塢��άΪ����
C�������������õĸ��ϲ������ںϳ���֬�Ļ����м�����̼��ά����ǿ��
D������ɻ�������ʹ�õĸ����մ���������ά���մɸ��϶��ɵIJ����Ƴɵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ڿ���������Դ��(����)
A. ʯ�� B. ���� C. ��Ȼ�� D. ú
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҺX���ܺ���Na+��Fe3+��Ca2+��SO42-�� CO32- ��Cl-��I-�еļ������ӡ�Ϊȷ������ɣ���Ʋ��������ʵ�飺

��������ʵ�飬�����Ʋ��������
A. ��ҺX���Ƿ����Na+����Ҫͨ����ɫ��Ӧ��һ��ȷ��
B. ��ҺX��һ������Fe3+��Ca2+��SO42-
C. Ϊȷ����ҺX���Ƿ���Cl-����ȡ��Һ2����CCl4�����ȡ����ȡ�ϲ�Һ�����AgNO3��Һ
D. ��ҺX������ΪNa2CO3��NaI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����������21���͵���Դ��������Ҫ��������Ϊ�뵼����ϵĹ���̫���ܷ�������о�����Ҫ�����á����й��ڹ��˵������ȷ���� ( )
A����Ȼ���й�Ԫ�صĺ�����ḻ B����Ȼ���д��ڴ������ʹ�
C���ߴ��ȵĹ豻�������������оƬ D�����ά����Ҫ�ɷ���Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ص�ұ���ɲ������·�����2KF+CaC21237��1423CCaF2+2K��+2C�������й�˵��������
A���÷�Ӧ����������KF������������K
B���÷�Ӧ��˵��C�Ļ�ԭ�Դ���K
C�����KF��Һ�������Ʊ�������
D��CaC2��CaF2��Ϊ���ӻ���������������Ӹ����Ⱦ�Ϊ2��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com