
����Ŀ��Ԫ�ص��ʼ��仯�����й㷺��;����������ڱ��е�������Ԫ�����֪ʶ�ش��������⣺
(1)��ԭ������������˳��(ϡ���������)������˵����ȷ����_______��
a.���ʵ��۵㽵��
b.ԭ�Ӱ뾶�ͼ����Ӱ뾶����С
c.Ԫ�صĽ����Լ������ǽ�������ǿ
d.�������Ӧ��ˮ������Լ�����������ǿ
(2)�����������ļ���������_______�����ȶ��ԣ�H2O____H2S(��>��<��=)��
(3)д��SiCl4�ĵ���ʽ��________��
(4)��֪������M�ɵ������ڵ���������Ԫ�ذ�ԭ�Ӹ�����1:1��ɣ����ȶ�����ˮ��Ӧ����̸��ɫ����A��������ɫ�д�������ζ����B��C����Ӧ���ʵ�ת����ϵ��ͼ��

����֪M��Ħ������Ϊ135g/mol��д��M�Ļ�ѧʽ_____��
����ѡһ�ֺ��ʵ�������Y��д��C��Ũ��Һ��Y��Ӧ����D�����ӷ�Ӧ����ʽ_______��
��M�е�һ��Ԫ�ؿ��γɻ�����KXO3��������ʵ������O2�������Ӵ�����400��ʱKXO3�ֽ�ֻ���������Σ�����һ�����������Σ���һ���ε��������Ӹ�����Ϊ1��1��д���÷�Ӧ�Ļ�ѧ����ʽ��____________��
���𰸡� c Na+(��������) > 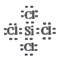 S2Cl2 MnO2+2Cl-+4H+=Mn2++Cl2��+2H2O(��2MnO4-+10C1-+16H+=2Mn2++5Cl2��+8H2O����������Ҳ����) 4KCIO3
S2Cl2 MnO2+2Cl-+4H+=Mn2++Cl2��+2H2O(��2MnO4-+10C1-+16H+=2Mn2++5Cl2��+8H2O����������Ҳ����) 4KCIO3![]() KCl+3KClO4
KCl+3KClO4
����������1���ᣮ�������ʵ��۵㽵�ͣ���Na��Mg��Al��Si��ԭ�Ӿ��壩�����ǽ��������Ƿ��Ӿ��壬�۵�Ƚ������ʵͣ�����������Si��Al��Mg��S��P��Na��Cl2��Ar��ѡ�����⣮ԭ�Ӱ뾶�����Ӱ뾶����С�����������У�����ԭ�������ĵ�����ԭ�Ӱ뾶��С�������Ӱ뾶��Ҫ�����������ӽ������ۣ�������ֻ��2�����Ӳ㣬���ź˵���������뾶��С������������3�����Ӳ㣬���ź˵������������С�����������Ӱ뾶������������Ӱ뾶���������ӵ������ӣ��뾶������ѡ������ �㣮�����Լ������ǽ�������ǿ��ͬһ�����У����ź˵�����ĵ�����Ԫ�صĽ������������ǽ���������ǿ��ѡ�����ȷ���䣮����������Ӧ��ˮ������Լ�����������ǿ��ѡ������ѡ�㣻�����������Ļ�ԭ��Խǿ����Ӧ���ӵ�������Խ�������Ե��������������������ļ���������Na+(��������)���ǽ�����O��S��Ԫ�صķǽ�����Խǿ����Ӧ���⻯��Խ�ȶ��������ȶ��ԣ� H2O��H2S��(3) SiCl4Ϊ���ۻ���������ʽΪ��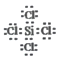 ��(4) M��ˮ��Ӧ����̸��ɫ����A��ӦΪ���ʣ���������ɫ�д�������ζ����B��C��ӦΪ����������Ȼ������壩��������M�ɵ������ڵ���������Ԫ�ذ�ԭ�Ӹ�����1:1��ɣ����ȶ��� M��Ħ������Ϊ135g/mol������֪MΪS2Cl2�����֪DΪ������EΪ���ᡣ��������������֪��M�Ļ�ѧʽΪS2Cl2����C��Ũ��ҺŨ�������Ȼ���Y��Ϊ�������̻�������ط�Ӧ����D�����������ӷ�Ӧ����ʽΪMnO2+2Cl-+4H+=Mn2++Cl2��+2H2O��2MnO4-+10C1-+16H+=2Mn2++5Cl2��+8H2O����M�е�һ��Ԫ����Ԫ�ؿ��γɻ�����KXO3��KClO3��������ʵ������O2�������Ӵ�����400��ʱKClO3�ֽ�ֻ���������Σ�����һ������������KCl����Ԫ�ػ��ϼ۽��ͣ�����һ��������Ԫ�ػ��ϼ����ߣ����������Ӹ�����Ϊ1��1����ΪKClO4���÷�Ӧ�Ļ�ѧ����ʽΪ��4KClO3
��(4) M��ˮ��Ӧ����̸��ɫ����A��ӦΪ���ʣ���������ɫ�д�������ζ����B��C��ӦΪ����������Ȼ������壩��������M�ɵ������ڵ���������Ԫ�ذ�ԭ�Ӹ�����1:1��ɣ����ȶ��� M��Ħ������Ϊ135g/mol������֪MΪS2Cl2�����֪DΪ������EΪ���ᡣ��������������֪��M�Ļ�ѧʽΪS2Cl2����C��Ũ��ҺŨ�������Ȼ���Y��Ϊ�������̻�������ط�Ӧ����D�����������ӷ�Ӧ����ʽΪMnO2+2Cl-+4H+=Mn2++Cl2��+2H2O��2MnO4-+10C1-+16H+=2Mn2++5Cl2��+8H2O����M�е�һ��Ԫ����Ԫ�ؿ��γɻ�����KXO3��KClO3��������ʵ������O2�������Ӵ�����400��ʱKClO3�ֽ�ֻ���������Σ�����һ������������KCl����Ԫ�ػ��ϼ۽��ͣ�����һ��������Ԫ�ػ��ϼ����ߣ����������Ӹ�����Ϊ1��1����ΪKClO4���÷�Ӧ�Ļ�ѧ����ʽΪ��4KClO3![]() KCl+3KClO4��
KCl+3KClO4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��һ����Ҫ��ʯ�ͻ���ԭ�ϣ����������Ʊ�ϩ���������ľ��ü�ֵ��������壬����һ�ֹ���ԭ������:
��C3H8(g)![]() C3H6(g)+H2(g)��H1
C3H6(g)+H2(g)��H1
��C3H8(g)![]() C2H4(g)+CH4(g) ��H2=+81.7kJ/mol
C2H4(g)+CH4(g) ��H2=+81.7kJ/mol
��C2H4(g)+H2(g)![]() C2H6(g) ��H3
C2H6(g) ��H3
��C3H8(g) +H2(g)![]() CH4(g)+C2H6(g) ��H4=-54.8kJ/mol
CH4(g)+C2H6(g) ��H4=-54.8kJ/mol
(1)���㷴Ӧ�۵ķ�Ӧ�ȡ�H3=______________��
(2)��������ƽ�ⳣ���������ѽ����ѡ�������¶ȹ�ϵ��ͼ1��ʾ����ͼ���жϡ�H2____0����ҵ�����в��õ��¶�600-650�棬ԭ����__________________��
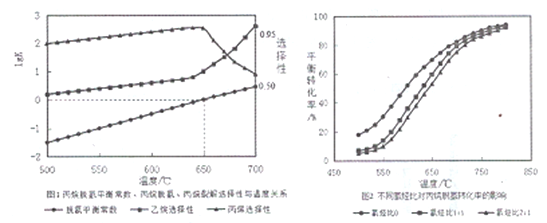
(3)�¶�Ϊ650��ʱ����1L��������Ͷ��1molC3H8��1molH2������Ӧ���������������C3H8����������Ϊ(����3λ��Ч���֣���ͬ)_________________(��֪: ![]() )
)
(4)��ͬ�����Ⱥ��¶ȶԱ�Ժ����ƽ��ת���ʵ�Ӱ������ͼ2��ʾ����ͬ�¶��£�����������ƽ��ת�����½���ԭ����__________________��
(5)��ϩ���������������Ƶñ�ϩ��(��HR��ʾ������볣��Ka=5.55��10-5)�������£���ϩ���Ƶ�ˮ�ⳣ��Ϊ________����0.2mol/LHR��0.1mol/LNaOH�������ϣ�����Һ�е�����Ũ�ȴ�С˳��Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ѡ������������������ǰ��һ�����ں��ߵ���
A. ��pH=4������ʹ���ֱ�ϡ�ͳ�pH=5����Һ������ˮ����
B. pH=10��NaOH��Ba(OH)2��Һ��ˮ�ĵ���̶�
C. ���ʵ���Ũ����ȵ�(NH4)2SO4��Һ��(NH4)2CO3��Һ��NH4+�����ʵ���Ũ��
D. ��ͬ�¶��£�10mL0.1mol��L-1�Ĵ�����100mL0.01mo1��L-1�Ĵ�����H+�����ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(NH4)2SO4��һ�ֳ����Ļ��ʣ�ij������ʯ�ࡢNH3��H2O��CO2�Ʊ�(NH4)2SO4�Ĺ����������£�

����˵����ȷ����
A. ͨ��NH3��CO2��˳����Ի���
B. ����2Ϊ����Һ����Ũ������ȴ�ᾧ�����ˣ��ɵ�(NH4)2SO4
C. ������з�Ӧ�����ӷ���ʽΪCa2++2NH3+CO2+H2O=CaCO3��+2NH4+
D. ͨ���NH2��CO2��Ӧ�������ҹ���������CO2��ѭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ע���ķ����������и���������в���ȷ���ǣ� ��
A.������������Һ������
B.ʳ���е�ɳ�����ܽ���ˣ������ᾧ��
C.�������������е�����ʳ�Σ�������
D.��ȥ�Ҵ����ܽ����ʳ�Σ����ˣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M�Ǻϳɿ����ػһ�ù�ص��м�����ϳ�·��������

��֪��
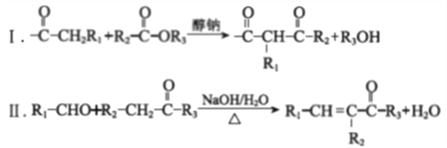
��R1��R2��R3������������ԭ����
��1��A�к��еĹ����ŵ�����Ϊ�Ѽ�����ԭ�ӡ�________��________��
��2��A��C��Ӧ�Ļ�ѧ����ʽ��________��
��3��C��D�ķ�Ӧ������________��
��4��E�Ľṹ��ʽ��________��
��5��I�ĺ˴Ź���������ֻ��һ�����շ���
������a��________��
��H��I��Ӧ�Ļ�ѧ����ʽ��________��
��I��K��Ӧ�Ļ�ѧ����ʽ��________��
��6��L�Ľṹ��ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ��ȷ�ӦH2+Cl2![]() 2HCl������˵����ȷ����
2HCl������˵����ȷ����
A���÷�Ӧ�漰�����Ӽ����ۼ��Ķ������γ�
B���÷�Ӧ�У���ѧ��ֻת��Ϊ����
C���Ͽ�1molH��H����1molCl��Cl�������յ���������С���γ�1molH��Cl�����ų�������
D����Ӧ�������е����������ڲ��������е�������
[
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�ڸ���Ŀ����о��ú�,����������Һ�е������ӵ��ǣ� ��
A.Cl2B.Cl-C.HCIOD.H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѧ�ҷ�����һ���·��ӣ������п��ĵ���������Ľṹ������ʽΪC60������˵����ȷ����
A.C60��һ�����͵Ļ�����
B.C60��ʯī����̼��ͬ��������
C.C60����Ȼû�����Ӽ���������Ϊ���Ӿ���
D.C60��Է�������Ϊ360
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com