
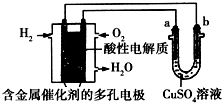
| A. | 此装置用于铁表面镀铜时,a为铁 | |
| B. | 此装置用于电镀铜时,硫酸铜溶液的浓度不变 | |
| C. | 燃料电池中正极反应为$\frac{1}{2}$O2+2e-+2H+═H2O | |
| D. | 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜 |
分析 氢氧燃料电池中,通入氢气的电极一定是负极,通入氧气的电极一定是正极,和正极相连的是电解池的阳极,和负极相连的是电解池的阴极;电镀时,电解质溶液中离子浓度不变,电解精炼铜时,粗铜作阳极,精铜作阴极,根据得失电子守恒进行计算.
解答 解:氢氧燃料电池中,通入氢气的电极一定是负极,通入氧气的电极一定是正极,故b极为阴极,a极为阳极.
A、铁表面镀铜时,金属铜必须作阳极,金属铁作阴极,所以a为金属铜,故A错误;
B、此装置用于电镀铜时,金属铜必须作阳极,电解前后硫酸铜溶液的浓度不变,故B正确;
C、氢氧燃料电池中,通入氧气的电极一定是正极,在酸性环境下,氧气放电的反应为:$\frac{1}{2}$O2+2H++2e-=H2O,故C正确;
D、电解精炼铜时,粗铜作阳极,精铜作阴极,1mol水生成,转移2mol电子,可得到64g铜,故D正确.
故选A.
点评 本题考查了氢氧燃料电池的工作原理和电解精炼铜、电镀原理等知识,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
| 实验序号 | 金属质量/g | 金属状态 | C(H2SO4)/mol.-L | V(H2SO4)/mL | 溶液温度 | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.1 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.1 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.1 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.1 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.1 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.1 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.1 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
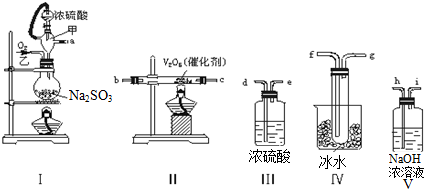
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5g35Cl2气体的体积约为1.12L | |
| D. | 35Cl2气体的摩尔质量为70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数c>d | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子半径X2+<W3+ | D. | 第一电离能X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用渗析法除去淀粉中混有的NaCl | |
| D. | 已知${I}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | HX为弱酸,且电离平衡常数Ka≈1×10-10 | |
| B. | 水的电离程度:M点大于N点 | |
| C. | P点c(Cl-)=0.05mol•L-1. | |
| D. | M点c(HX)-c(X-)>c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
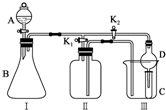

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com