
| 容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | / |
| Ⅱ | 607 | 0.22 | 0.82 | / | |
| Ⅲ | 620 | 0.1 | 0.4 | / | 6.74×10-3 |
| A. | 该反应正反应为放热反应 | |
| B. | 607K时该反应的平衡常数为2.50×10-3 | |
| C. | 容器Ⅱ达到平衡时容器中COS的物质的量为0.02mol | |
| D. | 容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动 |
分析 A、很据三行式计算607K时的平衡常数,结合温度变化和化学平衡常数之间的关系确定反应的吸放热情况;
B、根据三行式计算平衡常数的大小;
C、根据前两组实验,体积不变,初始投料增加1倍,则达到平衡时各物质的物质的量加倍;
D、根据浓度对平衡移动的影响来判断平衡的而移动方向.
解答 解:A、CO2(g)+H2S(g)?COS(g)+H2O(g)
初始量:0.11 0.41 0 0
变化量:0.01 0.01 0.01 0.01
平衡量:0.1 0.4 0.01 0.01
反应前后系数和相等,所以此时K=$\frac{[COS][{H}_{2}O]}{[C{O}_{2}][{H}_{2}S]}$=$\frac{0.01×0.01}{0.1×0.4}$=0.0025<6.74×10-3,温度升高,K增大,所以反应是吸热的过程,故A错误;
B、607K时该反应的平衡常数为2.50×10-3,故B正确;
C、根据前两组实验,体积不变,初始投料增加1倍,则达到平衡时各物质的物质的量加倍,Ⅱ达到平衡时容器中COS的物质的量为0.02mol,故C正确;
D、容器Ⅲ达平衡时,再充入少量氦气,各物质的浓度不变,所以平衡不移动,故D错误.
故选BC.
点评 本题涉及化学平衡的计算以及化学平衡移动原理的应用知识,注意知识的归纳和梳理是关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 HCN+OH-
HCN+OH-查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水是一种弱电解质 | B. | NH4ClO4溶液显酸性 | ||
| C. | NaClO4中含有离子键和共价键 | D. | NH4ClO4只有氧化性,没有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在化学反应中,${\;}_{1}^{1}$H2O可转变为D2O | |
| B. | “加碘食盐”生产中碘添加剂为单质I2 | |
| C. | 实验室用带玻璃塞的棕色瓶贮存液Br2 | |
| D. | 电解饱和MgCl2溶液时在阴极得到Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+
三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +3H2O
+3H2O| 物质 | 相对 分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中 溶解性 |
| 甘油 | 92 | 1.2636 | 290 (分解) | 溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 三乙酸甘油酯 | 218 | 1.1596 | 258 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件一定为减小压强 | |
| C. | 该容器的容积为2 L,B的起始物质的量为0.02 mol | |
| D. | t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g)?B(g)+2C(g)△H=-50a kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 活化分子具有的能量是活化能 | |
| C. | 活化分子的总数越多,反应速率越快 | |
| D. | 单位时间内有效碰撞次数越多,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
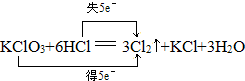 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com