
现有四种元素的基态原子的电子排布式如下: ①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5 则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:①>③>②>④
科目:高中化学 来源: 题型:
将2.56 g Cu与一定量的浓硝酸反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05 mol B.1 mol C.1.05 mol D.0.13 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
A.1 mol任何粒子的粒子数叫阿伏加德罗常数,12g 12C含有阿伏加德罗常数个碳原子
B.1 mol硫酸在水溶液中电离出的离子数约为2NA
C.硫酸根离子的摩尔质量是96 g·mol-1
D.同温同压下,相同体积的任何气体含有相同数目的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A.共价化合物中不可能含有离子键 B.有共价键的化合物,不一定是共价化合物
C.离子化合物中可能存在共价键 D.原子以极性键结合的分子,肯定是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素X的逐级电离能如右图所示,下列说法正确的是
A.X元素可能为+4价 B.X为非金属
C.X为第五周期元素 D.X与氯反应时最可能生成的阳离子为X3+
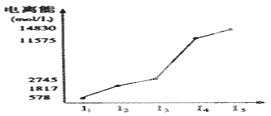
查看答案和解析>>
科目:高中化学 来源: 题型:
A.B.C.D.E.F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;基态E原子p能级上有一对成对电子,C.F两种元素的原子最外层共有13个电子。回答下列问题:
(1)D.E.F中电负性最大的是 (填写元素符号)。
(2)写出D原子的外围电子排图为 。
(3)B.C.E分别与A形成的化合物中沸点最高的是 。
(4)C与D形成的化合物的化学式是 ,请写出其溶于NaOH的离子方程式 ;
(5)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是( )
A.浓硝酸使紫色石蕊试液先变红后退色——酸性和强氧化性
B.不能用稀硝酸与锌反应制取氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞的氢氧化钠溶液红色退去——强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
将浓硫酸和2 mol/L的硫酸在实验室中敞口放置。它们的质量和放置天数的关系如下图所示。分析a、b曲线变化的原因是( )
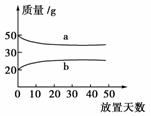
A.a升华、b冷凝 B.a蒸发、b吸水
C.a蒸发、b潮解 D.a冷凝、b吸水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com