
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量 稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将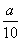 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:
 KMnO4 +
KMnO4 +  FeSO4 +
FeSO4 +  H2SO4 ===
H2SO4 ===  Fe2(SO4)3 +
Fe2(SO4)3 +
 MnSO4 +
MnSO4 +  K2SO4 +
K2SO4 +  H2O
H2O
(2)在滴定实验中不能选择________式滴定管,理由是________
____________________________________________________;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为________和________;
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一________(填“准确”、“不准确”或“不一定准确”),理由是_____________________________;
②方案二________(填“准确”、“不准确”或“不一定准确”),理由是_____________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)CO(g)+H2(g)不能确
定上述可逆反应在一定条件下已达到化学平衡状态的是 ( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)
M(g)
+N(g),所得实验数据如下表:
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡是,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
向一容积为1L 的密闭容器中加入一定量的X、Y,
发生化学反应aX(g)+2Y(s)  bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息判断,下列说法中正确的是
A.用X表示0~ 10min内该反应的平均速率为v(X)=0.045mol/(L·min)
10min内该反应的平均速率为v(X)=0.045mol/(L·min)
B.化学方程式中a:b= 1:3,
C.推测在第7min时曲线变化的原因可能是增加X的浓度
D.推测该反应处于化学平衡状态的时间是10min--13min及第20min 后
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对饰刻银的原因进行了如下探究:
【实验】
制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO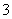 能氧化Ag。
能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:________。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO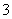 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。

【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO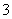 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空 格):
格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了 腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了 (“氧化”或“还原”)反应,其电极反应式是 。
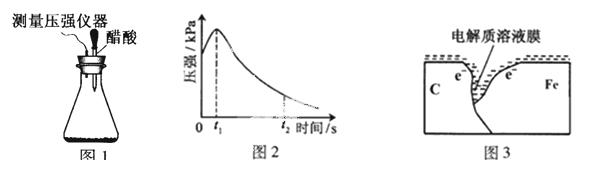
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:  ;
;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目:高中化学 来源: 题型:
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是 。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:

①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、 和 。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1 K2Cr2O7标准溶液bmL,则滤液中
c(Fe2+)= mol·L—1
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是 (填序号)。
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行  D.用氨水调节pH=7
D.用氨水调节pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O 。若反应得到的FePO4·2H2O固体呈棕黄色 ,则磷酸铁中混有的杂质可能为 。
,则磷酸铁中混有的杂质可能为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质。过程如下:
提出问题:
①在周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,Fe2+的稳定性小于Fe3+的,Cu+的稳定性也小于Cu2+的吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
实验方案:
(1)解决问题①需用到的药品有CuSO4溶液、________(填试剂名称),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80~100℃时,得到 80 g黑色固体粉末,继续加热到1  000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为________。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,则反应的离子方程式为___________________。
000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为________。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,则反应的离子方程式为___________________。
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体,该气体的化学式为
__________________________________________________。
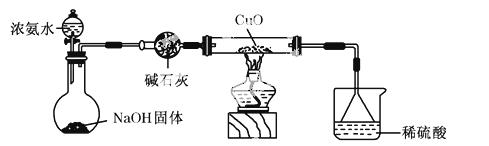
实验结论:
(4)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是_____________________。
(5)根据实验方案(2),得出的Cu+和Cu2+稳定性大小的结论:高温时________;在酸性溶液中________。
(6)CuO能被NH3还原。
问题讨论:
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验方案验证NH3与CuO反应后生成的红色物质中是否含有A:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g)
2NO(g) 
已知该反应在 2404℃时,平衡常数 K=6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为 。
(2)该温度下,向 2 L 密闭容器中充入 N2 和 O2 各 1 mol,平衡时,N2 的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内 N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应________(填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是_______。
(4)将 N2、O2 的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_________。
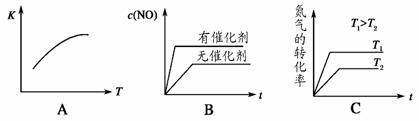
(5)向恒温恒容的密闭容器中充入等物质的量的 N2 和 O2,达到平衡状态后再向其中充入一定量 NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com