
下列叙述正确的是( )
|
| A. | 标准状况下任何气体的摩尔体积都是22.4 L |
|
| B. | 1mol气体的体积若是22.4 L,它必定处于标准状况 |
|
| C. | 两种气体的物质的量之比等于其原子个数比 |
|
| D. | 标准状况下,1mol H2和O2的混合气体的体积是22.4 L |
考点:
阿伏加德罗定律及推论.
专题:
阿伏加德罗常数和阿伏加德罗定律.
分析:
A、标准状况下任何气体的摩尔体积都是22.4 L/mol;
B、物质的量一定时,影响气体体积的因素有压强、温度;
C、气体分子含有的原子数目不一定相等;
D、标准状况下,气体摩尔体积为22.4L/mol,气体摩尔体积适用于混合气体.
解答:
解:A、标准状况下,1mol气体的体积为22.4L,气体的摩尔体积是22.4 L/mol,故A错误;
B、物质的量一定时,影响气体体积的因素有压强、温度,1mol气体的体积是22.4 L,所处状态不一定是标准状况,故B错误;
C、物质的量相同,若气体分子含有相同的原子数目,则两种气体的物质的量之比等于其原子个数比,但气体分子含有的原子数目不一定相等,两种气体的物质的量之比不一定等于其原子个数比,故C错误;
D、气体摩尔体积适用于混合气体,标准状况下,气体摩尔体积为22.4L/mol,1mol H2和O2的混合气体的体积是22.4 L,故D正确;
故选D.
点评:
考查气体摩尔体积、阿伏伽德罗定律及推论,难度不大,注意气体摩尔体积的使用条件与对象,可以根据pV=nRT理解阿伏伽德罗定律及推论.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是()
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体摩尔体积的描述中正确的是( )
-A.-相同条件下,气体物质的量越大,气体摩尔体积越大
-B.-通常状况下的气体摩尔体积大于22.4L/mol
-C.-非标准状况下的气体摩尔体积不可能为22.4L/mol
-D.-在标准状况下,混合气体的气体摩尔体积比22.4L/mol大
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)147gH2SO4中含 mol原子,与 g CO2所含有的氧原子数相同.
标准状况下,2.4g某气体的体积为672mL,则此气体的相对分子质量为 .
(3)在标准状况下,V L氨气溶于1L水中,所得溶液的密度为ρg•cm﹣3,溶液的质量分数为ω.则此溶液的物质的量浓度为: 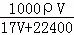 或
或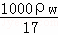 mol/L
mol/L
(4)将Wg胆矾(CuSO4 •5H2O )溶解在VmL水中,得到饱和溶液,测得该饱和溶液的密度为ρg/cm3,则溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:正确的操作顺序是( )
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④滴入稀盐酸至无气泡产生;
⑤过滤.
|
| A. | ③②①⑤④ | B. | ①②③⑤④ | C. | ②③①④⑤ | D. | ③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度与50mL 1mol/L AlCl3溶液中Cl﹣物质的量浓度相等的是( )
|
| A. | 150mL 2mol/L KCl溶液 | B. | 75mL 1.5mol/L MgCl2溶液 |
|
| C. | 100mL 1mol/L NaCl溶液 | D. | 25mL 2mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 标准状况下任何气体的摩尔体积都是22.4 L |
|
| B. | 1mol气体的体积若是22.4 L,它必定处于标准状况 |
|
| C. | 两种气体的物质的量之比等于其原子个数比 |
|
| D. | 标准状况下,1mol H2和O2的混合气体的体积是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)⇌CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是()

A. P3>P2 T3>T2 B. P2>P4 T4>T2
C. P1>P3 T3>T1 D. P1>P4 T2>T3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com