
【题目】下列各组物质相互反应后,没有碱生成的是 ( )
A. Na2O2溶于水 B. 红热的铁和水蒸气
C. 金属钠投入水中 D. Na2O投入水中
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示,下列分析正确的是
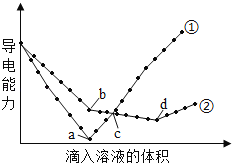
A. ②代表滴加H2SO4溶液的变化曲线
B. b点,两反应物物质的量之比为1: 2
C. a、d两点对应的溶液均显中性
D. c点,两溶液中含有相同物质的量浓度的OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Na+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一种或几种离子,取该溶液进行实验,其现象及转化如下图所示。

请回答下列问题:
(1)由整体的实验过程可判断溶液X中一定不存在的阴离子有______。
(2)产生气体A的离子方程式为____________。
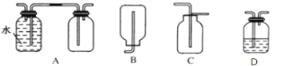
(3)在实验室中收集气体A,可选择如图装置中的______。
(4)写出④反应中生成溶液H的离子方程式____________。
(5)对不能确定是否存在的离子,请简述检测实验方案__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
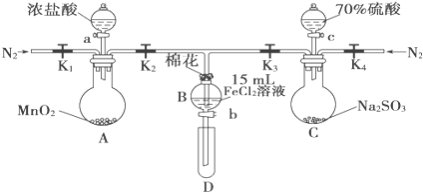
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________。
(2)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是__________________________。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的化学方程式__________________________。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为__________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示.他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是_____(填“甲”、“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有Fe2+ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有SO42﹣ |
(6)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有1/2的Br﹣被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
①第一份加入足量AgNO3溶液后,有白色沉淀产生。
②第二份加入足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图所示。
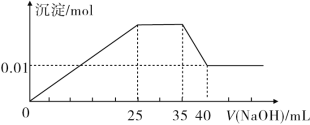
根据上述实验,完成下列问题:
(1)原溶液中一定不存在的离子是______________。
(2)25~35段发生反应的离子方程式为__________。
(3)35~40段发生反应的离子方程式为__________。
(4)实验所加的NaOH的浓度为________。
(5)原溶液中NO3-的物质的量为n(NO3-),根据提供的图像和数据,试计算n(NO3-)的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨烯(单层石墨)中含有C-C键的数目为3NA
C.60gSiO2中含Si—O键的个数为2NA
D. 六方最密堆积的配位数是12,空间利用率是74%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com