
| A. | 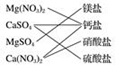 | B. | 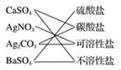 | C. | 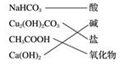 | D. | 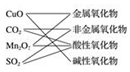 |
分析 A.钙盐是指电离产生钙离子的盐;
B.硫酸盐电离产生硫酸根离子的盐,碳酸银不溶于水;
C.电离产生阳离子全部是氢离子的化合物为酸;含两种元素一种为氧元素的化合物;
D.依据其构成中只含两种元素,其中一种一定为氧元素,另一种若为金属元素,则为金属氧化物;若为非金属,则为非金属氧化物;能与水作用生成酸或与碱作用生成盐和水的氧化物;能跟酸起反应,只生成盐和水的氧化物叫碱性氧化物解答.
解答 解:A.硝酸镁电离产生镁离子和硝酸根离子,属于镁盐不属于钙盐,故A错误;
B.硫酸钙电离产生硫酸根离子的盐,属于硫酸盐,碳酸银不溶于水,属于不溶性盐,故B错误;
C.碳酸氢钠属于盐,CH3COOH属于酸,故C错误;
D.氧化铜属于金属氧化物,属于碱性氧化物;二氧化碳属于非金属氧化物,属于酸性氧化物;五氧化二锰为金属氧化物,属于酸性氧化物,二氧化硫为非金属氧化物,属于酸性氧化物,故D正确;
故选D.
点评 本题考查物质的组成和分类,比较简单,属于基础题,学生应能识别常见物质的种类,并能利用其组成来判断物质的类别是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:推断题

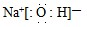 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
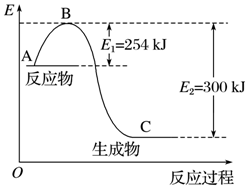 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ⑤⑥ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050、 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做焰色反应实验用的铂丝要用受热容易挥发的稀盐酸洗涤 | |
| B. | 观察K2SO4的焰色应透过蓝色的钴玻璃 | |
| C. | 可以用焰色反应来区别NaCl溶液和KCl溶液 | |
| D. | 焰色反应一定是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com