
在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,H2SO4恰好用完。
(1)此时在导线上有_______ mol电子通过。
(2)Zn片溶解的质量是_____________ g。
(3)原稀H2SO4的物质的量浓度是______________ mol/L。
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
下表是元素周期表的一部分,用化学符号回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
| |
(1)写出下列元素的符号:①_____,⑥_____,⑦_____。
(2)在这些元素中,最活泼的金属元素是____,最活泼的非金属元素是____,最不活泼的元素是____。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是_______,碱性最强的是_____,称为两性氢氧化物的是_________。
(4)在这些元素中,原子半径最小的是____,原子半径最大的是_____。
(5)在③与④,化学性质较活泼的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的叙述中不正确的是( )
A.向某溶液中依次加入BaCl2溶液和稀盐酸,有不溶于稀盐酸的白色沉淀生成,则该溶液中一定含S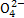
B.取醋酸钠溶液,用pH试纸检验,试纸变蓝,说明醋酸是弱酸
C.向装有碘水的分液漏斗中滴加CCl4,振荡、静置后分液,即可将碘萃取到CCl4中
D.读取滴定管内液体体积时,仰视读数,将导致读数偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列比较中正确的是( )
A.离子的还原性:S2- >Cl- >Br- >I- B.氧化性:F2 >Cl2 >S
C.酸性:H2SO4 >HClO4 >H3PO4 D.非金属性:F >Cl >S >O
查看答案和解析>>
科目:高中化学 来源: 题型:
有H、D、T三种原子它们之间的关系是____ _____。各1mol的H2、D2、T2三种单质中质子数之比是_________;在标准状况下,1L各种单质中它们的电子数之比是________,在标准状况下它们的单质的密度之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图中的实验方案,能达到实验目的的是 ( )
| A | B | C | D | |
| 实验方案 |
|
将NO2球浸泡在冰水和热水中 |
|
|
| 实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡 2NO2 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。
氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下:
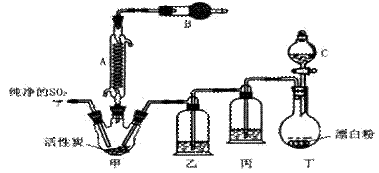
回答下列问题:
(1)仪器A的名称为______,甲中活性炭的作用是______,B中加入的药品是______。实验时从仪器C中放出溶液的操作方法是___________。
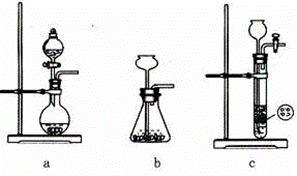
(2)装置丁中发生反应的离子方程式为___________。用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,下图中可选用的发生装置是________(填写字母)。
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________,分离产物的方法是_________。
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_______。为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:
A.A>B>C>D B.C>A>B>D C.A>C>D>B D.B>D>C>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com