
| ||
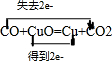 单线桥法:
单线桥法: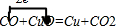 ,故答案为:
,故答案为: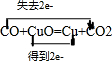 ;
;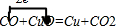 ;
;
| ||
| ||
| ||


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、锌粒与盐酸反应时,若加入适量氯化钠晶体,可明显加快反应速率 |
| B、恒温下,在饱和食盐水中加入少量食盐固体,固体不会发生任何改变 |
| C、90℃时的氯化钠溶液 pH<7,但仍然呈中性 |
| D、氯化钠溶液导电是化学变化,而熔融态氯化钠导电则是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X |
| X |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温、高压 |
| 催化剂 |
| A、各物质的量保持不变 |
| B、各物质的量继续改变 |
| C、V(逆)=V(正),正逆反应停止 |
| D、N2、H2、NH3的速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com