
| A. | 煤的干馏是化学变化,而煤的气化、液化是物理变化 | |
| B. | 石油裂解是为了获得更多汽油,以满足迅速增长的汽车需要 | |
| C. | 氢能、电能、风能都是无毒、无污染的绿色新能源,可以安全使用 | |
| D. | 玻璃是将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得的 |
科目:高中化学 来源: 题型:实验题
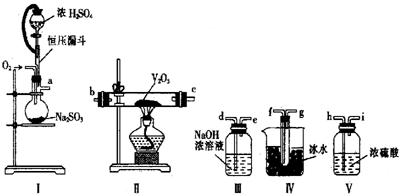
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
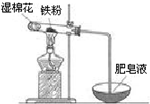 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 无法判断混合物中是否含有Na2O | B. | 由Ⅱ可知X中一定存在SiO2 | ||
| C. | 1.92g固体成分为Cu | D. | 15.6g混合物X中m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项[来 | 实验 | 现象 | 结论 |
| A | 常温下,等量等表面积的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | FeCl3溶液用于刻蚀铜制印刷电路板 | 溶液变蓝 | 氧化性:Cu2+>Fe2+ |
| C | 向FeCl2溶液中加入足量Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2溶液部分变质 |
| D | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、SiO2的晶体结构类型不同 | |
| B. | 加热硅、硫晶体使之熔化,克服的作用力不同 | |
| C. | HCl、NaCl溶于水,破坏的化学键类型相同 | |
| D. | NaOH、NH4Cl晶体中既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
| ③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
| 阴离子符号 | 物质的量浓度/mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com