
【题目】下列说法正确的是( )
A.含离子键的化合物是离子化合物,含共价键的化合物是共价化合物
B.离子键的形成过程中一定有电子得失
C.第ⅠA、ⅡA族元素与第ⅥA、ⅦA族元素一定形成离子键
D.离子键与共价键的本质都是静电作用
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知元素X、Y、Z质子数都小于18,并且质子数X+Y=Z。X原子的电子层数与核外电子总数相同,Z原子有两个电子层,最外层电子数是内层电子数的三倍,则:
(1)写出元素符号:X_______, Y _________ ; Z的离子结构示意图为__________。
(2)由Y、Z组成,且质量比为7:20的化合物化学式为____________ 。
(3)X、Z可以形成两种常见化合物A和B,A中X、Z原子个数比为2 : 1,则A的摩尔质量为_____,实验室常用B制少量的氧气,写出化学反应方程式_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是 ( )
A. 0.1 mol·L-1 NH4HS溶液中有:c(NH![]() )+c(NH3·H2O)=c(HS-)+c(S2-)+c(H2S)
)+c(NH3·H2O)=c(HS-)+c(S2-)+c(H2S)
B. 25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合后,c(NH![]() )=c(Cl-),则a>0.01mol·L-1
)=c(Cl-),则a>0.01mol·L-1
C. 等浓度的HCN和NaCN等体积混合后溶液呈碱性,则有:c(CN-)>c(HCN)
D. 等体积等pH的醋酸和盐酸溶液,分别与一定浓度的氢氧化钠溶液完全中和,醋酸消耗的氢氧化钠溶液体积多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池若不进行回收利用,将对水体产生严重污染。某兴趣小组对废旧镍电池正极材料[由Ni(OH)2、碳粉、Fe2O3等涂覆在铝箔上制成]进行回收研究,设计实验流程如下图所示:
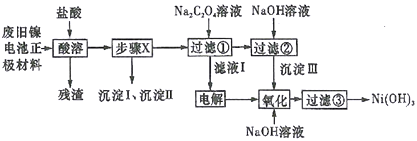
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+,Cl2能氧化Ni2+为Ni3+;
②NiO+2HCl=NiCl2+H2O;
③Fe3+、Al3+、Ni3+以氢氧化物形式沉淀时溶液的pH如下表所示:
离子 | Fe3+ | Al3+ | Ni2+ |
开始沉淀时的pH | 1.5 | 3.5 | 7.0 |
完全沉淀时的pH | 3.2 | 4.8 | 9.0 |
④Ksp[Ni(OH)2]=5.0×10-16,Ksp(NiC2O4)=4.0×10-10。
请回答下列问题:
(1)酸溶后所留残渣的主要成份__________(填物质名称)。
(2)步骤X的操作为用NiO调节溶液pH,首先析出的沉淀Ⅰ是__________(填化学式),调节过程中pH不能低于___________。
(3)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则加入Na2C2O4溶液后析出的沉淀是__________。
(4)写出生成沉淀Ⅲ的离子方程式__________,该反应的平衡常数为__________。
(5)用化学反应方程式表示沉淀Ⅲ转化为Ni(OH)3________________________。
(6)过滤③后如何检验Ni(OH)3已洗涤干净____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时体积相同,发生反应:2NO2(g)N2O4(g)△H<0.一段时间后相继达到平衡状态..下列说法中错误的是( )
A. 该反应的平衡常数表达式K=c(N2O4)/c2(NO2)
B. 若乙容器内气体的压强保持不变,说明反应已达到平衡状态
C. 平衡时NO2体积分数:甲>乙
D. 达到平衡所需时间,甲所需时间短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列化合物:①NH4Al(SO4)2、②NH4HSO4、③NH4Cl、④NH3H2O、⑤CH3COONH4, 回答下列问题。
(1)NH4HSO4 的电离方程式为_____
(2)等浓度的②④⑤三种溶液中,NH4+浓度由大到小的顺序是__________。(用序号表示)
(3)室温时,pH=3 的 NH4Cl 溶液中:c(C1ˉ)-c(NH4+) =_________mol·L-1 (填数值)
(4)NH4Al(SO4)2可作净水剂,其理由是___________________________________用必要的化学用语和相关文字说明)
(5)将浓度均为 0.1 mol·L﹣1 的③和④溶液混合,关于所得溶液下列说法错误的是_____
A.若溶液显酸性,则 c(C1ˉ)>c(NH4+ )>c(H+ )>c(OH- )
B.若 c(C1ˉ)=c(NH4+),则溶液显中性
C.若③和④等体积混合,则所得溶液满足关系:c(NH4+)+c(NH3H2O)=0.2mol·L-1
D.其浓度大小不可能为:c(C1ˉ)>c(NH4+)>c(OHˉ)>c(H+)
(6)已知 CH3COONH4 溶液为中性,试推断(NH4)2CO3 溶液的 pH________7 (填“<”“>”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们占据三个周期。Y原子最外层电子数是电子层数的3倍。同由W、X、Z和SO42-组成一种离子化合物的水溶液中滴加稀氢氧化钠溶液,产生沉淀与加入的氢氧化钠溶液的体积关系如图所示。下列说法正确的是
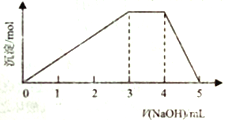
A. X、Y两种元素的非金属性强,其单质化学性质也很活泼
B. Z与X、Y形成的常见盐的水溶液会使蓝色石蕊试纸变红
C. Z的最高价氧化物对应的水化物可溶于X的最简单氢化物的水溶液中
D. 由W、X、Y三种元素只能组成一种盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定已部分变质的过氧化钠样品纯度的装置如图所示(Q为弹性良好的气球不与药品反应,取定量的样品放入其中)。按图示安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中。下列说法中不正确的是
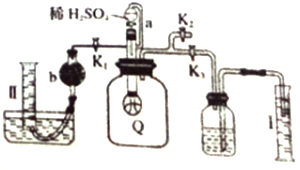
A. 稀硫酸滴入气球中,Q 中能生成两种气体
B. 准确读取量筒I读数后,先关闭K3然后打开K2,再缓缓打开K1,准确读取量筒II读数
C. I、II中测量的气体体积的差值即为CO2的体积(相同状况下)
D. b中的固体试剂可以是碱石灰,也可以是无水氯化钙。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产甲醇的反应为CO(g)+2H2(g)CH3OH(g) △H=akJ/mol.图1表示反应中能量的变化;图2表示一定温度下,在体积固定为1L的密闭容器中加入2molH2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图..下列叙述错误的是( )
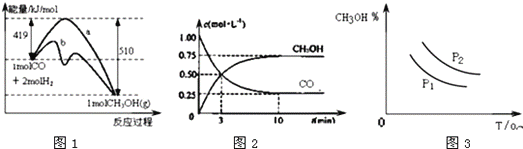
A. CO和H2合成CH3OH的反应:△H<0,△S<0
B. 保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小
C. 图1中曲线b可表示使用了催化剂的能量变化情况
D. 图3中曲线可表示在不同压强P1.P2(P1<P2)条件下甲醇百分含量随温度变化的情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com