
| A. | 塑料 | B. | 陶瓷 | C. | 玻璃 | D. | 水泥 |
科目:高中化学 来源: 题型:选择题

| A. | 200℃时,反应从开始到平衡的平均速率 v(A)=0.08 mol•L-1•min-1 | |
| B. | 若 0~5 min 时容器与外界的热交换总量为 m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol | |
| C. | 200℃时,若在第 6 min 再向体系中加入催化剂,可使 v 正>v 逆 | |
| D. | 200℃时,平衡后再充入 2 mol C,则达到平衡时,化学平衡常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
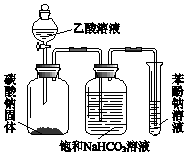 某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.
某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的化学反应叫吸热反应 | |
| B. | 化学反应必然伴随能量变化,没有能量变化的化学反应是不存在的 | |
| C. | 化学反应的能量来自物质状态变化所产生的能量 | |
| D. | 断裂化学键要放热,形成化学键要吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: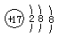 | |
| B. | CH4的球棍模型:? | |
| C. | 氯化镁的电子式: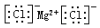 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往溴化亚铁溶液中加入足量氯水2Fe2++Cl2═2 Fe3++2Cl- | |
| B. | 铝与氢氧化钠溶液反应Al+4OH-═[Al(OH)4]- | |
| C. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 往氯化铝溶液中加入氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白磷和红磷互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,所以${\;}_{2}^{4}$He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 严格控制硝酸厂的尾气处理 | |
| B. | 倡导使用无磷洗衣粉 | |
| C. | 研究新型催化剂,消除汽车尾气污染 | |
| D. | 禁止使用含氟电冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
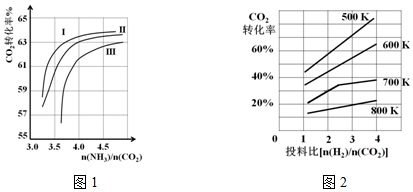
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com