

分析 装置I:制备二氧化硫,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑,装置II:酸性氧化物二氧化硫和氢氧化钠反应导致溶液PH值减小,从而使酚酞变为无色,装置III:酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,装置IV:硫化钠(Na2S)溶液和SO2反应,烧杯中的浓NaOH溶液可吸收二氧化硫,防止污染空气.
(1)根据仪器的特征以及常见仪器的名称解答;
(2)酸性氧化物二氧化硫和氢氧化钠反应导致溶液PH值减小,从而使酚酞变为无色;
(3)酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,红色变浅直至消失;若将装置III中的酸性KMnO4溶液换为氯水,氯水和二氧化硫反应生成硫酸和盐酸;
(4)硫化钠和二氧化硫反应生成硫和氢氧化钠;
(5)二氧化硫为大气污染物,需进行尾气处理,氢氧化钠能吸收二氧化硫;
(6)第一支试管中发生的反应为2HNO3+2H2O+3SO2=2NO↑+3H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl,第二支试管中:二氧化硫为酸性氧化物,能够与氢氧化钠反应生成亚硫酸钠和水,亚硫酸钠能够与氯化钡反应生成亚硫酸钡沉淀,据此分析解答.
解答 解:(1)仪器A具有球形、长颈、具有玻璃活塞的漏斗,为分液漏斗,
故答案为:分液漏斗;
(2)装置II:酸性氧化物二氧化硫和氢氧化钠反应导致溶液PH值减小,从而使酚酞变为无色,所以装置II中的现象为红色变浅直至消失,
故答案为:红色变浅直至消失;酸性氧化物二氧化硫和氢氧化钠反应导致溶液PH值减小,从而使酚酞变为无色;
(3)装置III:酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,同时自身被还原生成锰离子,由化合价升降总数相等,可知反应为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,若将装置III中的酸性KMnO4溶液换为氯水,二氧化硫通入氯水中反应生成硫酸和盐酸,反应的离子方程式为SO2+Cl2+2H2O═4H++2Cl-+SO42-,则装置III中的现象是氯水的浅黄绿色褪去,
故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;氯水的浅黄绿色褪去;
(4)硫化钠中-2价的硫具有还原性,二氧化硫中+4价的硫具有氧化性,两者反应生成硫和氢氧化钠,反应方程式为:2Na2S+SO2+2H2O═4NaOH+3S↓,
故答案为:2Na2S+SO2+2H2O═4NaOH+3S↓;
(5)氢氧化钠能吸收二氧化硫,所以烧杯中的浓NaOH溶液的作用是:吸收酸性有毒气体,防止造成污染和毒害,
故答案为:吸收酸性有毒气体,防止造成污染和毒害;
(6)在BaCl2溶液中通入SO2气体不反应,将上述通入SO2气体的BaCl2溶液分盛两支试管,一支加硝酸,另一支加烧碱溶液,加硝酸的试管中硝酸会氧化二氧化硫为硫酸,故能生成白色沉淀,加烧碱溶液,二氧化硫会与氢氧化钠反应生成亚硫酸盐,与氯化钡会生成亚硫酸钡白色沉淀;
a、氯化钡是强酸强碱盐,不是两性,故a错误;
b、加硝酸的试管生成的是硫酸钡,加烧碱的试管生成的是亚硫酸钡,故b错误;
c、二氧化硫被硝酸氧化说明具有还原性易被氧化,与碱反应说明溶于水生成亚硫酸呈酸性,具有酸酐的性质,故c正确;
d、增强碱性会使二氧化硫转化为亚硫酸盐,使亚硫酸根离子浓度增大,故d正确;
故答案为:cd.
点评 本题考查二氧化硫的化学性质探究,为高频考点,把握物质的性质、发生的反应、实验装置的作用为解答的关键,侧重分析与实验能力的综合考查,试题培养了学生的化学实验能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应速率v正(X)=$\frac{m}{n}$ v逆(Y) | B. | 降低温度,c$\frac{c(Y)}{c(Z)}$的值变小 | ||
| C. | 增加Y的物质的量,X的转化率增大 | D. | 加入X,反应的△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱:苛性钠、纯碱、熟石灰 | |
| B. | 盐:胆矾、小苏打、铜绿 | |
| C. | 碱性氧化物:氧化铜、七氧化二锰、氧化铝 | |
| D. | 无丁达尔现象的分散系:碘的四氧化碳溶液、淀粉溶液、氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的能量变化只表现为反应放热或吸热两种形式 | |
| B. | 一个反应的反应物总能量大于生成物总能量,则该反应的焓变一定小于零 | |
| C. | 燃烧热的大小与热化学方程式中可燃物计量系数成正比 | |
| D. | 含1mol硫酸的稀溶液与足量NaOH稀溶液反应生成水所放出的热量为中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
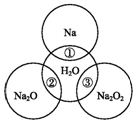 如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 反应③最多能产生0.1 mol O2 | |
| B. | 反应①的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2O2中阴阳离子数目之比为1:1 | |
| D. | ①②③充分反应后所得溶液中溶质的质量分数:②=③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的摩尔质量为36.5g | |
| B. | 1mol H2SO4 的质量为98 g.mol-1 | |
| C. | 任何物质的摩尔质量都等于他的相对分子质量或相对原子质量 | |
| D. | CO2 的摩尔质量是H2 的摩尔质量的22倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原混合气体的体积为1.1VL | |
| B. | 原混合气体的体积为1.2VL | |
| C. | 反应达到限度时,气体A消耗掉0.05 VL | |
| D. | 反应达到限度时,气体B消耗掉0.05 VL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
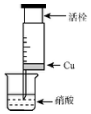 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com