
下列说法正确的是( )
A.CHCl3是正四面体形
B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形
C.二氧化碳中碳原子为sp杂化,为直线形分子
D.NH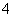 是三角锥形
是三角锥形
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
T℃,向5L恒容密闭容器中充入1molSO3气体,发生反应2SO3(g)⇌2SO2(g)+O2(g)
△H=+196kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量.当温度度不变时,改变某一条件,下列结论正确的是( )
| 条件改变 | 结论 | |
| A | 平衡后向容器中充入1molHe | 平衡常数不变,混合气体的密度也不变 |
| B | 起始时向容器中充入0.5molSO2、0.25molO2和2molSO3 | 反应达到平衡前v(正)>v(逆) |
| C | 起始时向容器中充入1molSO2和0.5mol O2 | 达到平衡时共放出78.4kJ的热量 |
| D | 起始时向容器中充入1molSO2和0.5molO2 | 达到平衡时,SO2的转化率为60% |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,纯水中c(H+)=2×10﹣7 mol•L﹣1,则此温度下水的离子积为 .若温度不变,滴入稀盐酸使c(H+)=5×10﹣4 mol•L﹣1,则此时c(OH﹣)= .由水电离产生的c(H+)为 ,此时温度 (填“高于”、“低于”或“等于”)25°C.
查看答案和解析>>
科目:高中化学 来源: 题型:
有关①100mL 0.1mol/L NaHCO3 ②100mL 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO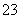 )>c(H2CO3)
)>c(H2CO3)
D.②溶液中:c(HCO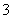 )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”。某研究性学习小组拟对融雪氯盐(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究。
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
该小组设计流程如图:
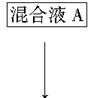



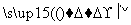

(1)加入混合液A的主要成分是________________(填化学式)。
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入________溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成。下列三种溶液,其沉淀效果最好的是________。
A.0.1mol·L-1 Na2CO3溶液
B.0.1mol·L-1 Na2SO3溶液
C.0.1mol·L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在________________以下。
(4)对溶液B加热并不断滴加6mol·L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C。该操作的目的是__________________________________________________。
(5)溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到有大量固体析出时停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于价层电子对互斥模型(VSEPR模型)的叙述中不正确的是( )
A.VSEPR模型可用来预测分子的立体结构
B.分子中价电子对相互排斥决定了分子的空间结构
C.中心原子上的孤电子对不参与互相排斥
D.分子中键角越大,价电子对相互排斥力越小,分子越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质结构的表述正确的是( )
A.次氯酸的电子式H: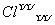 :
: :
:
B.二氧化硅的分子式:SiO2
C.硫原子的最外层电子排布式:3s23p4
D.钠离子的结构示意图:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com