
某工业废水中可能含有如下几种阴阳离子:
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al + X + OH- =AlO2-+ NH3 + N2 +
该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
【知识点】离子反应,氧化还原反应,溶度积的计算 B1 B3 H5
【答案解析】(1)NO3- SO42-; Ba2+
(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)16Al + 9NO3-+ 7OH- =16AlO2- + NH3↑+ 4N2↑+ 2H2O ; NH3 、N2 ; 9.6g
(4)2
解析: (1)少量的无色气体NO生成,气体遇空气立即变为红棕色NO2,说明含有NO3-;加入BaCl2溶液,有白色沉淀生成说明含有SO42-,故不含Ba2+;过量的NaOH溶液,有红褐色沉淀生成说明含有Fe3+;向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成说明含有Al3+,故不含CO32-和SiO32-。(3)从此反应中可以看出X反应完了之后生成了NH3和N2,根据元素守恒得到X应为NO3-;反应前有氢元素,根据元素守恒得到反应后也应该有氢元素,故产物中还有H2O;根据化合价升降相等可以得到此反应。分析本反应中的化合价的变化可以看到氮元素化合价降低即还原产物为NH3 和 N2 ;
根据反应16Al + 9NO3-+ 7OH- =16AlO2- + NH3↑+ 4N2↑+ 2H2O
16mol 9molNO3-
n (Al) 0.2mol
n (Al)=16×0.2/9 mol
故m (Al)= 9.6g
(4)Ksp=1.0×10-38= c(Fe3+)×c3(OH-)
c(Fe3+)=1.0×10-2mol·L-1,故c (OH-)=1.0×10-12 mol·L-1,又KW=1.0×10-14,故c (H+)=1.0×10-2 mol·L-1,pH=2,故将Fe3+转换为Fe(OH)3沉调节溶液pH至少大于2。
【思路点拨】本题考查了离子反应和离子共存的应用,氧化还原反应的应用,溶度积的计算,涉及到的知识内容较多,综合性较强。


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
下列各组离子,在指定的环境中可能大量共存的是( )
|
| A. | 水电离出来的c(H+)=10﹣13mol/L的溶液:K+、HCO3﹣、Br﹣、Ba2+ |
|
| B. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl﹣、NO3﹣ |
|
| C. | 与金属铝反应只能放出氢气的溶液:NO3﹣、K+、Cl﹣、Na+、OH﹣ |
|
| D. | c(H+)>c(OH﹣)的溶液中:Na+、K+、SO42﹣、S2﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C都是有机化合物,且有如下转化关系:A B
B C,A的相对分子质量比B大2,C的相对分子量比B大16,C能与过量的NaOH反应生成一种常见的气体,以下说法正确的是( )
C,A的相对分子质量比B大2,C的相对分子量比B大16,C能与过量的NaOH反应生成一种常见的气体,以下说法正确的是( )
|
| A. | A是乙炔,B是乙烯 | B. | A是乙烯,B是乙烷 |
|
| C. | A是乙醇,B是乙醛 | D. | A是环己烷,B是苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途.
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图.
①下列对尼泊金酯的判断不正确的是 .
a.能发生水解反应 b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上 d.与浓溴水反应时,1mol尼泊金酯消耗1mol Br2
②尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是 .
(2)C8H8O3的另一种同分异构体甲满足以下条件:
①与足量的NaOH溶液完全反应时,1mol甲消耗3molNaOH
②遇FeCl3溶液显色③苯环上的一氯取代物只有一种
甲可能的结构简式是 、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
.根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是( )
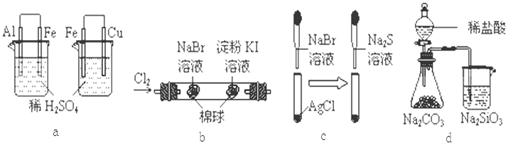
| 选项 | 实验 | 实验现象 | 结论 |
| A | a | 左烧杯铁表面有气泡,右烧杯铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl < AgBr <Ag2S |
| D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下的密闭容器中,可逆反应A(g)+3B(g)2C(g)(g表示气态),在下列四种状态中处于平衡状态的是( )
| 速率 | A | B | C | D |
| v正/mol·(L·s)-1 | vA=1 | vB=2 | vA=1 | vC=1 |
| v逆/mol·(L·s)-1 | vB=1 | vC=2 | vC=2 | vC=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:
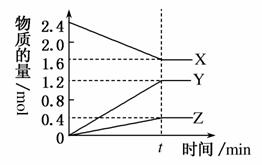
(1)该反应的化学方程式是___________________________。
(2)反应起始至t,Y的平均反应速率是_________________。
(3)X的转化率是_____________________________________。
(4)关于该反应的说法正确的是________。
A.到达t时刻反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度时,水的离子积为1.0×10-12 mol2·L-2,若该温度下某溶液中[H+]为1.0×10-7 mol·L-1,则该溶液( )
A.呈碱性 B.呈酸性 C.呈中性 D.[OH-]=1 000[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
关于次氯酸性质的描述,错误的是( )
|
| A. | 不稳定,易分解放出氧气 | B. | 能使潮湿的有色布条褪色 |
|
| C. | 具有漂白作用和消毒作用 | D. | 是一种比碳酸酸性强的酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com