
| A.电离程度 | B.酸的物质的量浓度 |
| C.与Zn反应开始时的反应速率 | D.与足量的Zn反应产生H2量 |
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.大于10 | B.小于10 | C.等于10 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加水稀释100倍后,两溶液的pH均为4 |
| B.使温度都升高20℃后,两溶液的pH均不变 |
| C.与足量的锌反应,盐酸的反应速率比醋酸大 |
| D.加足量的锌充分反应后,醋酸产生的氢气比盐酸多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在气体反应中,升高温度和增大压强都能使单位体积内的反应物中活化分子数和活化分子百分数同时增大 |
| B.pH等于7的溶液一定呈中性 |
| C.c(H+)=c(OH-)的溶液一定呈中性 |
| D.在0.1mol/L的醋酸溶液中,加入少量水平衡向右移,电离平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有②和③ | B.只有②和④ | C.只有①和③ | D.只有① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
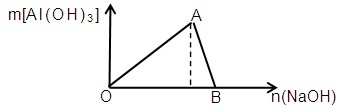
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示:| T/℃ | 300 | 400 |
| K | 3.41 | 0.50 |
 2Y(g)达到平衡状态,时间为t
2Y(g)达到平衡状态,时间为t 1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该离子液体中含的氨分子 |
| B.硝酸乙基铵水溶液呈碱性 |
C.硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++2H2O C2H5NH2·H2O+H3O+ C2H5NH2·H2O+H3O+ |
| D.同温度下相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
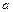 )表示:
)表示: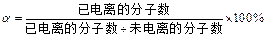 ,现有pH均为4的HCl和
,现有pH均为4的HCl和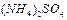 溶液,则两种溶液中H2O的电离度之比为( )
溶液,则两种溶液中H2O的电离度之比为( )| A.1:2 | B.2:5 | C.1:106 | D.106:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com