
【题目】化合物G是一种低毒性、低残留、环境友好的农药,可以通过以下方法合成。

(1)A→B的反应类型为______________。
(2)下列说法不正确的是________。
A.化合物B能使Br2/CCl4溶液褪色 B.化合物A能发生银镜反应
C.化合物C能与FeCl3发生显色反应 D.化合物E的分子式为C12H12Cl2O2
(3)化合物C中的含氧官能团名称为________和________。
(4)化合物X的分子式为C5H12O2,则X的结构简式为______________。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式:__________。①属于芳香族化合物且能发生银镜反应②分子中只有3种不同化学环境的氢
(6)请以![]() 为原料制备化合物
为原料制备化合物![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_________________。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_________________。
【答案】取代反应 B 羰基 (酚)羟基 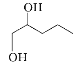
【解析】
A与ClCH2COCH3发生取代反应生成B,B发生移位生成C,E和X反应生成F,根据F的结构简式可知X应该是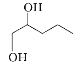 ,F与
,F与![]() 发生取代反应生成G,据此解答。
发生取代反应生成G,据此解答。
(1)A→B是A与ClCH2COCH3发生取代反应。
(2)A.化合物B中含有碳碳双键,能使Br2/CCl4溶液褪色,A正确;
B.化合物A中不存在醛基,不能发生银镜反应,B错误;
C.化合物C中含有酚羟基,能与FeCl3发生显色反应,C正确;
D.化合物E的分子式为C12H12Cl2O2,D正确;
答案选B。
(3)化合物C的结构简式为 ,其中的含氧官能团名称为羰基、(酚)羟基。
,其中的含氧官能团名称为羰基、(酚)羟基。
(4)化合物X的分子式为C5H12O2,则X的结构简式为 。
。
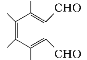
(5)①属于芳香族化合物且能发生银镜反应,含有苯环和醛基;②分子中只有3种不同化学环境的氢,则满足条件的D的一种同分异构体的结构简式为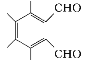 。
。
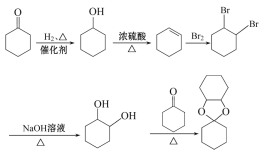
(6)以![]() 为原料制备化合物
为原料制备化合物![]() ,根据题干信息可知
,根据题干信息可知![]() 可由
可由![]() 和
和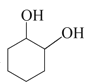 发生取代反应得到,
发生取代反应得到, 可由
可由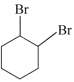 发生水解反应得到,
发生水解反应得到, 可由
可由![]() 发生加成反应得到,
发生加成反应得到,![]() 可由环己醇发生消去反应得到,环己醇可由
可由环己醇发生消去反应得到,环己醇可由![]() 发生加成反应得到,则合成路线流程图为
发生加成反应得到,则合成路线流程图为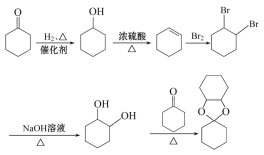 。
。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
| ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ② | ③ | Ne | ||||||
3 | Na | ④ | ⑤ | ⑥ | |||||
(1)④的原子序数是________;
(2)⑤的原子结构示意图是____________;
(3)②和③两种元素的非金属性强弱关系是:②______③(填“>”、“<”或“=”);
(4)①和⑥两种元素组成的化合物中含有的化学键是____(填“共价”或“离子”)键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴(8分)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则

①电解池中X极上的电极反应式是 。
在X极附近观察到的现象是 。
②Y电极上的电极反应式是 ,
检验该电极反应产物的方法是 。
⑵(6分)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是
②Y电极的材料是 ,电极反应式是
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验,请回答:

(1)X中的非金属元素是_________。
(2)黑色化合物高温空气红棕色化合物的化学方程式是___________________。
(3)设计实验方案检验黄色溶液中的金属阳离子_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是合成二氢荆芥内酯的重要原料,其结构简式如下图,下列检验A中官能团的试剂和顺序正确的是( )

A. 先加酸性高锰酸钾溶液,后加银氨溶液,微热
B. 先加溴水,后加酸性高锰酸钾溶液
C. 先加银氨溶液,微热,再加入溴水
D. 先加入新制氢氧化铜,微热,酸化后再加溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中正确的是( )
A. 有单质参加或有单质生成的反应一定是氧化还原反应
B. 氧化还原反应的本质是元素化合价的升降
C. 金属单质在化学反应中一定作还原剂
D. 失电子的反应物在反应中作还原剂,反应中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物(a)![]() (b)
(b)![]() (c)
(c)![]() 的说法正确的是
的说法正确的是
A. (a)(b)(c)均能与溴水发生化学反应
B. (b)二氯代物有两种
C. (a)(b)(c)互为同分异构体
D. (a)中所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成与应用一直是众多科学家研究的热门话题,目前该研究领域已经催生了三位诺贝尔化学奖得主,N2不仅可以与H2合成氨气,N2还可以与其他物质反应生成氨气,回答下列相关问题:
(1)德国化学家哈伯研究“N2(g)+3H2(g)![]() 2NH3(g)”反应贡献巨大,1918年荣获诺贝尔化学奖,已知该反应在298K时,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2
2NH3(g)”反应贡献巨大,1918年荣获诺贝尔化学奖,已知该反应在298K时,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2
①若从平衡常数角度分析,反应限度已经较大,但为何化工生产中还需要使用催化剂:____________________________________________
②升高温度,反应物的转化率会降低,而实际化工生产中常常采用700K左右的温度,其原因是____________________________________________。
(2)1931年,科学家卡尔博施因改进合成氨方法而荣获该年度诺贝尔化学奖。研究发现,催化剂Fe3O4·Al2O3)颗粒大小不同、温度不同,平衡混合气体中氨气的含量不同由如图可以得出合成氨的适宜条件是_________________________________

(3)2007年,德国埃特尔发现了合成氨催化机理,开端了表面动力学的研究。研究发现,常温恒压密闭容器中,N2在催化剂表面可以与水发生反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
①下列各项能够作为判断该反应一定达到平衡的依据是___________(填标号)。
A.容器中N2(g)、NH3(g)、O2(g)的浓度之比为2:4:3
B.N2与NH3浓度之比恒定不变
C.v(N2)正=2v(NH3)逆
D.混合气体中氨气的质量分数不变
E.压强保持不变
②平衡后若分别改变下列一个条件,可以使N2转化率增大的是___________(填标号。)
A.转移掉部分O2 B.转移掉部分NH3
C.适当增加H2O(l)的量 D.增加N2的量
(4)科学研究发现,天然气CH4(g)与N2(g)在催化剂作用下可以直接用于合成氨气,同时生成副产物焦炭,已知每转移1mol电子,该反应吸收的热量为QkJ。
①写出该反应的热化学反应方程式_________________________________
②700℃时,将3molCH4与3molN2在2L的恒定密闭容器中发生上述反应,达到平衡时生成 amolC,求此时混合气体中氨气的体积分数______________________(用含a的数学表达式即可,下同);该温度下的平衡常数Kc=_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com