
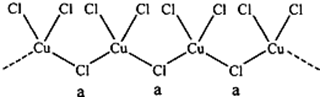
分析 a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,据此判断;一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,阴离子构成与CuCl3一样,但CuCl3原子团的化合价为-2,据此书写.
解答 解:a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,杂化轨道类型为sp3,一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,阴离子构成与CuCl3一样,但CuCl3原子团的化合价为-2,其化学式为:K2CuCl3,
故答案为:sp3;K2CuCl3.
点评 本题考查了原子杂化方式的判断,根据价层电子对互斥理论来分析解答即可,为学习难点和易错点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| B. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| C. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 | |
| D. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=A+n | D. | 所含质子数=A+Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
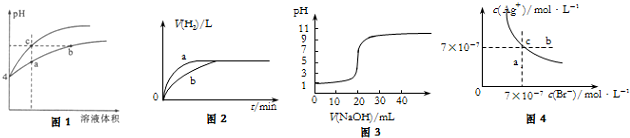
| A. | 图1某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH 变化曲线,用等浓度NaOH溶液分别和等体积b、c处溶液反应,消耗NaOH溶液体积Vb>Vc | |
| B. | 图2中曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)与同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | |
| C. | 图3表示25℃用0.1000 mol•L-1NaOH溶液滴定20.00mL 0.1000 mol•L-1 CH3COOH溶液得到的滴定曲线 | |
| D. | 图4表示某温度下AgBr在水中的沉淀溶解平衡曲线的图象,向AgBr的饱和溶液中加入NaBr固体,可以使溶液由c点到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
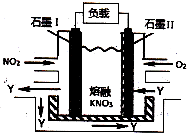
| A. | 放电时,N03-向石墨Ⅱ电极迁移 | |
| B. | 石墨Ⅱ附近发生的反应为:NO+O2+e-═NO3- | |
| C. | 电池总反应式为:4NO2+O2═2N2O5 | |
| D. | 当外电路通过4mol e-,负极上共产生2mol N2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ④⑥⑧ | C. | ①②④⑤ | D. | ④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com