
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要以钨酸盐( 钨元素的化合价为+6)形式存在于黑钨矿中。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4 ),还含有少量Si、As的化合物。由黑钨矿石冶冻金属钨的工艺流程如图所示:
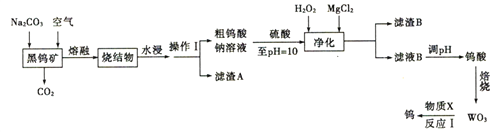
已知:①烧结物的成分为Fe2O3、MnO2、Na2SO3、Na2WO4、Na3AsO3、Na3AsO4;
②上述流程中,钨的化合价只在反应Ⅰ中发生改变;
③常温下钨酸难溶于水。
请回答下列问题:
(l)操作Ⅰ用到的玻璃仪器为______________。
(2)写出FeWO4在熔融条件下与Na2CO3、空气反应生成Fe2O3 的化学方程式________________。
(3)pH=10的溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,MgCl2 的作用是______________,加入H2O2 时发生反应的离子方程式为____________________。
(4)已知:室温时Ksp[Mg(OH)2]=5.6×10-12,在“净化”阶段,常温时保持溶液pH=10,为防止产生Mg(OH)2 沉淀,溶液中c(Mg2+)应不超过_________mol/L。
(5)反应Ⅰ中,物质X 可为H2、CO。
①已知:C(s)+H2O(g)![]() CO(g)+H2(g) △H1=a kJ/mol
CO(g)+H2(g) △H1=a kJ/mol
W3(s)+3H2(g)![]() W(s)+3H2O (g) △H2=bkJ/mol
W(s)+3H2O (g) △H2=bkJ/mol
WO3(s)+3CO(g)![]() W(s)+3CO2(g) △H3=c kJ/mol
W(s)+3CO2(g) △H3=c kJ/mol
根据上述信息,2WO3(s)+3C(s)![]() 2W(s)+3CO2(g)的△H=____________kJ/mol(用含a、b、c的式子表示)。
2W(s)+3CO2(g)的△H=____________kJ/mol(用含a、b、c的式子表示)。
②若黑钨矿中钨的质量分数为ω,提炼过程中利用率为b,欲用akg 黑钨矿制得化学纯金属钨,则产品中杂质允许含量的最大值为_____________kg(化工产品等级标准:优级纯≥99.8%,分析纯≥99.7%,化学纯≥99.5%)
【答案】 漏斗、玻璃棒、烧杯 4FeWO4+O2+4Na2CO3![]() 2Fe2O3+4Na2WO4+4CO2↑ 除去溶液中的SiO32-、HAsO42- H2O2+HAsO32-=HAsO42-+H2O 5.6×10-4 3a+b+c
2Fe2O3+4Na2WO4+4CO2↑ 除去溶液中的SiO32-、HAsO42- H2O2+HAsO32-=HAsO42-+H2O 5.6×10-4 3a+b+c ![]()
【解析】(l)操作Ⅰ是将烧结物水浸后分离得到溶液和滤渣,故为过滤,用到的玻璃仪器为漏斗、玻璃棒、烧杯;(2)根据流程可知,FeWO4在熔融条件下与Na2CO3、空气反应生成Fe2O3同时生成Na2WO4和二氧化碳,反应的化学方程式为4FeWO4+O2+4Na2CO3![]() 2Fe2O3+4Na2WO4+4CO2↑;(3)pH=10的溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,MgCl2的作用是除去溶液中的SiO32-、HAsO42-,加入H2O2时将HAsO32-氧化,发生反应的离子方程式为H2O2+HAsO32-=HAsO42-+H2O;(4) pH=10,c(OH-)=10-4mol/L,Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)= c(Mg2+)×(10-4mol/L)2=5.6×10-12,c(Mg2+)=5.6×10-4,故在“净化”阶段,常温时保持溶液为防止产生Mg(OH)2沉淀,溶液中c(Mg2+)应不超过5.6×10-4mol/L;(5)①已知:Ⅰ、C(s)+H2O(g)
2Fe2O3+4Na2WO4+4CO2↑;(3)pH=10的溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,MgCl2的作用是除去溶液中的SiO32-、HAsO42-,加入H2O2时将HAsO32-氧化,发生反应的离子方程式为H2O2+HAsO32-=HAsO42-+H2O;(4) pH=10,c(OH-)=10-4mol/L,Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)= c(Mg2+)×(10-4mol/L)2=5.6×10-12,c(Mg2+)=5.6×10-4,故在“净化”阶段,常温时保持溶液为防止产生Mg(OH)2沉淀,溶液中c(Mg2+)应不超过5.6×10-4mol/L;(5)①已知:Ⅰ、C(s)+H2O(g)![]() CO(g)+H2(g) △H1=akJ/mol
CO(g)+H2(g) △H1=akJ/mol
Ⅱ、W3(s)+3H2(g)![]() W(s)+3H2O(g) △H2=bkJ/mol
W(s)+3H2O(g) △H2=bkJ/mol
Ⅲ、WO3(s)+3CO(g)![]() W(s)+3CO2(g) △H3=ckJ/mol
W(s)+3CO2(g) △H3=ckJ/mol
根据盖斯定律,由Ⅰ×3+Ⅱ+Ⅲ得反应2WO3(s)+3C(s)![]() 2W(s)+3CO2(g)的△H=3a+b+c kJ/mol;②若黑钨矿中钨的质量分数为ω,提炼过程中利用率为b,欲用akg黑钨矿制得化学纯金属钨,则产品中杂质允许含量的最大值为
2W(s)+3CO2(g)的△H=3a+b+c kJ/mol;②若黑钨矿中钨的质量分数为ω,提炼过程中利用率为b,欲用akg黑钨矿制得化学纯金属钨,则产品中杂质允许含量的最大值为![]() kg。
kg。


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是

A. N电极应该接电源的负极 B. 装置中所用离子交换膜为阴离子交换膜
C. H2SO4溶液浓度a%等于b% D. M电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某NaHCO3样品的纯度(杂质为NaCl),进行如下实验:
(1)称取2.000g样品,配成200mL待测液,配制待测液所需定量仪器有;
(2)在锥形瓶中放入20.00mL待测液,滴加2滴甲基橙,摇匀.用0.100mol/L的标准盐酸滴定,边滴边摇动锥形瓶,眼睛注视 . 直到滴入最后一滴盐酸,溶液颜色由色变为色,并在内不发生变化,停止滴定,记录读数.
(3)重复滴定实验1~2次,计算平均消耗盐酸22.60mL.重复实验的目的是 .
(4)所配待测液中NaHCO3的浓度为mol/L;样品中NaHCO3的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关人体细胞组成元素的叙述,正确的是
A.人体不同细胞的元素种类和含量都大致相同
B.构成细胞的微量元素的含量少,生理作用也小
C.组成人体的元素在非生物界中都能找到
D.C是最基本元素,也是细胞鲜重中含量最多的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,不能在溶液中大量共存的是( )
A.K+、Na+、NO3-、Cl-B.K+、H+、SO42-、Cl-
C.Na+、Cu2+、OH-、SO42-D.H+、Na+、Cl-、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的说法中,正确的是
A.许多胶体能进行电泳是因为这些胶体带电
B.在溶有 1mol 氢氧化铁的胶体中,含有 NA 个氢氧化铁胶粒
C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列选项不正确的是( )
A.已知A-+H2B(过量)= HA+HB- , 则结合H+的能力:HB-<A-<B2-
B.在0.1 mol/L氨水中滴加0.1 mol/L盐酸,恰好完全中和时溶液pH=a , 则由水电离产生的c(OH-)=10-a mol/L
C.将c molL-1的醋酸溶液与0.02 molL-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka= ![]()
D.欲除去CuCl2溶液中混有少量的FeCl3 , 可加入CuO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com