
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
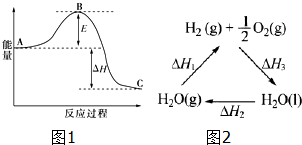
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)依据催化剂降低反应的活化能加快反应速率分析;结合已知N2(g)与H2(g)反应生成34g NH3(g),放出92.2kJ的热量,分析图象是合成氨反应N2(g)+3H2(g)=2NH3(g),计算得到;
(3)根据反应热等于反应物的总键能-生成物的总键能求算;
(4)根据图2写出反应2和反应3的热化学方程式,然后根据盖斯定律来分析.
解答 解:(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即2molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,
则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol,
故答案为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol;
(2)催化剂降低反应的活化能加快反应速率,则加催化剂会使图中E变小;已知N2(g)与H2(g)反应生成34g NH3(g),放出92.2kJ的热量,图象是表示的是反应$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)能量变化,由于生成34g氨气放热92.2kJ,则生成17g氨气时放热46.1KJ,故热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.1kJ/mol,
故答案为:小;-46.1kJ/mol;
(3)N2(g)+3H2(g)???2NH3(g)△H=945kJ•mol-1+436kJ•mol-1×3-391kJ•mol-1×6=-93kJ•mol-1=a kJ•mol-1,因此a=-93,故答案为:-93;
(4)根据图2可知:H2O(l)=H2O(g)△H2=+44kJ•mol-1②
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8kJ•mol-1③
将-③-②可得:H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H1=-(△H2+△H3)=-[(-285.8kJ•mol-1)+(+44kJ•mol-1)]=+241.8kJ•mol-1,
故答案为:-(△H2+△H3);+241.8kJ•mol-1.
点评 本题考查了热化学方程式书写方法和盖斯定律的计算应用等,焓变可以用反应物总键能-生成物总键能计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
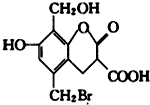 某有机物的结构简式如图,取足量的Na、NaOH 溶液和NaHCO3溶液分别和等物质的量的该有机物在一定的条件下反应(必要时可以加热),完全反应后消耗Na、NaOH和 NaHCO3三种物质的物质的量之比为( )
某有机物的结构简式如图,取足量的Na、NaOH 溶液和NaHCO3溶液分别和等物质的量的该有机物在一定的条件下反应(必要时可以加热),完全反应后消耗Na、NaOH和 NaHCO3三种物质的物质的量之比为( )| A. | 3:4:2 | B. | 3:5:2 | C. | 3:5:1 | D. | 3:4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成→消去→取代 | B. | 消去→加成→消去 | C. | 消去→加成→取代 | D. | 取代→消去→加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
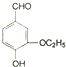 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.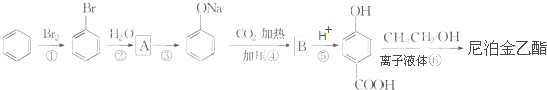
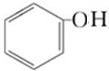 ,B
,B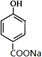 ;
;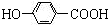 +CH3CH2OH$→_{△}^{离子液体}$
+CH3CH2OH$→_{△}^{离子液体}$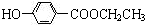 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2气体通入含有氢氧化钠的酚酞溶液中,溶液褪色 | |
| B. | 将SO2气体通入澄清石灰水中,溶液变浑浊 | |
| C. | 将SO2通入品红溶液中,溶液褪色 | |
| D. | 将SO2气体通入碘水溶液中,溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和NaOH溶液 | B. | NO2和水 | C. | NH3和水 | D. | Cl2和NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com