
| A. | 加热浓缩到溶液体积为$\frac{V}{2}$ L | |
| B. | 加入0.05 mol•L-1盐酸0.125V L | |
| C. | 加入10 mol•L-1盐酸0.1V L,再稀释至1.5V L | |
| D. | 标准状况下通入11.2 L氯化氢气体 |
分析 A.盐酸易挥发,加热浓缩时挥发的不仅是溶剂水,还有溶质HCl,所得溶液的浓度比期望值偏小;
B.向溶液中加入溶质或不同浓度的溶液会引起溶液体积的变化,所得溶液浓度与期望浓度都有偏差;
C.该方法合理,根据n=cV计算出两溶液中HCl的物质的量,再根据c=$\frac{n}{V}$计算所得溶液浓度是否为1mol/L;
D.通入氯化氢气体后,溶液体积会发生变化.
解答 解:A.盐酸具有挥发性,加热浓缩时挥发的不仅是溶剂水,还有部分溶质HCl,导致所得溶液的浓度比期望值偏小,该方法不适宜,故A错误;
B.向溶液中加入0.05 mol•L-1盐酸0.125V L,会引起溶液体积的变化,导致所得溶液浓度与期望浓度有偏差,故B错误;
C.加入10 mol•L-1盐酸0.1V L,混合液中HCl的物质的量为:10mol/L×0.1VL+0.5mol/L×VL=1.5Vmol,则所得溶液浓度为:$\frac{1.5Vmol}{1.5VL}$=1mol/L,该方法合理,所得溶液浓度为1mol/L,故C正确;
D.标准状况下通入11.2 L氯化氢气体,会导致溶液体积发生变化,则所得溶液浓度会发生变化,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意掌握配制一定物质的量浓度的溶液方法,试题培养了学生的分析能力及化学计算、化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
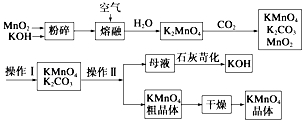 高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如下:
高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,水解平衡常数增大 | |
| B. | 升高温度,C(CO32-) 减小 | |
| C. | 稀释溶液,溶液中所有离子浓度均减小 | |
| D. | 加入NaOH(s),溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
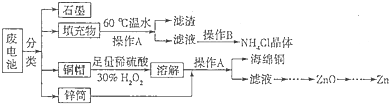
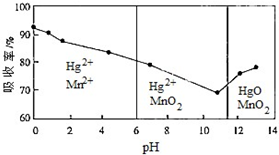
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜电解精炼时,应将粗铜与直流电源的正极相连 | |
| B. | 金属的吸氧腐蚀的过程中,正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 燃料电池中加入燃料的电极一定是电池的负极 | |
| D. | 在生产生活中,为保护钢铁器件免受腐蚀,应将该器件与直流电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
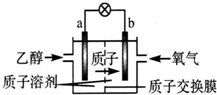 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )| A. | a极为电池的正极 | |
| B. | 电池正极的电极反应:4H++O2+4e-═2H2O | |
| C. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| D. | 设每个电子所带电量为q库仑,则1 mol乙醇被氧化产生12q库仑的电量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
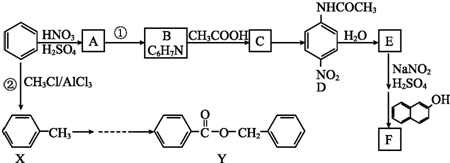
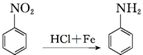
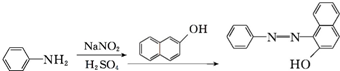
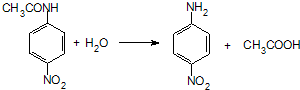 .
.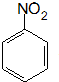 、F
、F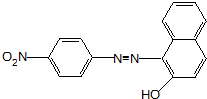 .
.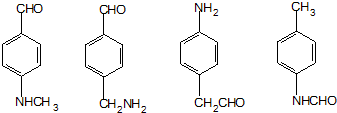 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
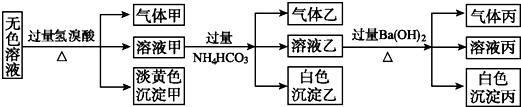
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com