
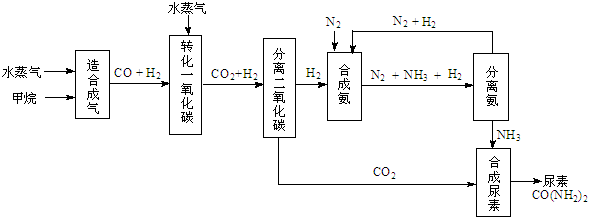
 CO(g)+3H2(g)����H��0
CO(g)+3H2(g)����H��0| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
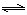 H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�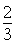 =4.8��108L
=4.8��108L 

 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������NH4HSO4���壬v��H2������ |
| B������Na2SO4���壬v��H2����С |
| C������CH3COONa���壬v��H2����С |
| D���μ�����CuSO4��Һ��v��H2����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ơ��ƿ��ƿ�����Ϸ��������ĭ |
| B����H2��I2��g����HI��ɵ�ƽ����ϵ����ѹ����ɫ���� |
| C��ʵ�����г����ű���ʳ��ˮ�ķ����ռ����� |
| D����ҵ����������Ĺ�����ʹ�ù����Ŀ�������߶�������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ | B����ѹ | C����ѹ | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� |
| A���٢� | B���ڢ� | C���ۢ� | D���٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
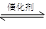 2CO2��N2
2CO2��N2| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/ mol��L-1 | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
| c(CO)/ mol��L-1 | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
 0�����>������<������=������
0����д��>������<������=������| ʵ���� | T/�� | NO��ʼŨ�� mol��L-1 | CO��ʼŨ�� mol��L-1 | �����ıȱ���� �O��g-1 |
| �� | 280 | 1.2��10-3 | 5.8��10-3 | 82 |
| �� | | | 5.8��10-3 | 124 |
| �� | 350 | 1.2��10-3 | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2N2O5(g)����֪�÷�Ӧ��ƽ�ⳣ����K300 ����K350 ������n(NO2)(��λ��mol)��ʱ��仯���±���
2N2O5(g)����֪�÷�Ӧ��ƽ�ⳣ����K300 ����K350 ������n(NO2)(��λ��mol)��ʱ��仯���±���| ʱ��(s) | 0 | 500 | 1000 | 1500 |
| t1�� | 20 | 13.96 | 10.08 | 10.08 |
| t2�� | 20 | a | b | c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


 ����ش��������⣺
����ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3C(g) ��H��0��ij�о�С���о���������������ʱ��ֻ�ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ����( )
3C(g) ��H��0��ij�о�С���о���������������ʱ��ֻ�ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ����( )
| A��ͼ���ʾ����t1ʱ�������¶ȶԷ�Ӧ���ʵ�Ӱ�� |
| B��ͼ���ʾ��һ����t1ʱ�̼��������Է�Ӧ���ʵ�Ӱ�� |
| C��ͼ���ʾ�����¶ȶԻ�ѧƽ���Ӱ�죬���ҵ��¶Ƚϸ� |
| D��ͼ���ʾ���Ǵ�����ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com