
【题目】M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z。下列说法中正确的是( )
A. Z是共价化合物
B. Z可表示为M2Y
C. Z的电子式可表示为 ![]()
D. M形成+2价阳离子
科目:高中化学 来源: 题型:
【题目】某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH相同、体积均为V0的两种酸溶液分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
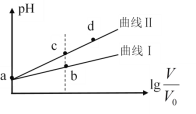
A.曲线Ⅰ代表CH3COOH溶液
B.溶液中水的电离程度:b点小于c点
C.相同体积a点的两种酸分别与NaOH溶液恰好中和后,溶液中n(NO2-)>n(CH3COO-)
D.由c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
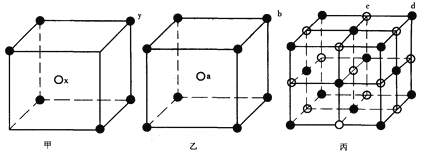
【题目】现有甲、乙、丙(如下图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按第26届国际计量大会重新定义,阿伏加德罗常数(NA)有了准确值6.02214076×1023。下列有关NA的说法正确的是( )
A.28g乙烯与丙烯的混合气体中含有4NA个C-H键
B.标准状况下,3.36LNO2中氧原子数目为0.3NA
C.1L1mol·L-1的CH3COOH溶液与1L0.5mol·L-1的NaOH溶液混合后,CH3COO-的数目为0.5NA
D.理论上,149gNaClO与足量KI溶液反应可得到NA个碘分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+l0CO2↑+8H2O 反应速率的影响因素,有关实验数据如下表所示:
编号 | 温度 ℃ | 催化 剂(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4溶液褪 色平均时间(min) | ||
体积(mL) | 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
下列说法不正确的是
A.a<12.7,b>6.7
B.可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
C.用H2C2O4表示该反应速率,v(实验1)约为6.6×l0-3 mol·L-1·min-1
D.用KMnO4表示该反应速率,v(实验3)>v(实验1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种主族元素组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A.原子半径:Y>Z>R>TB.XR2、WR2两种化合物中R的化合价相同
C.最高价氧化物对应的水化物的碱性:X>ZD.气态氢化物的稳定性:W<R<T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的综合利用是一个减少污染、提高燃料利用率的重要课题,其常用的方法包括煤的气化、液化以及转化为有机产品等。请回答下列问题:
(1)已知:I.C(s)、CO(g)、H2(g)的燃烧热依次为△H1=-393.5kJ·mol-1、△H2=-283.0kJ·mol-1、△H3=-285.8kJ·mol-1
II.H2O(l)=H2O(g)△H4=+44.0kJ·mol-1
则煤气化主要反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=___。
CO(g)+H2(g)的△H=___。
(2)现在一恒温的刚性容器中加入足量煤,并通入1mol水蒸气,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
①气体的密度保持不变;②断裂2molH-O键的同时生成1molH-H键;③CO的体积分数保持不变;④气体的平均摩尔质量不变;⑤CO与H2的比例保持不变;⑥容器的压强保持不变。
(3)气化后,将水煤气CO与H2化合CO(g)+2H2(g)![]() CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___v逆(填“大于”“小于”或“等于”)。
CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___v逆(填“大于”“小于”或“等于”)。
(4)关于CO(g)+2H2(g)![]() CH3OH(g),下列说法正确的是___(填字母)。
CH3OH(g),下列说法正确的是___(填字母)。
A.加压有利于速率加快和平衡向正反应方向移动
B.甲醇的平衡体积分数随着CO与H2投料比的增大而增大
C.使用催化性能好的催化剂,可提高H2的平衡转化率
D.在恒温恒容条件下达到平衡后,通入Ar,平衡向逆反应方向移动
E.已知E[CO(g)+2H2(g)]>E[CH3OH(g)](E表示物质的能量),则降温有利于提高正反应进行的程度
(5)在一特殊的恒容容器中,充入一定量的CO(g)与H2(g)来模拟CO(g)+2H2(g)![]() CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___;t之后v正又逐渐减小的原因为___。
CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___;t之后v正又逐渐减小的原因为___。
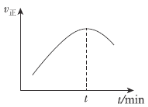
(6)煤经过一系列转化还可得到草酸。常温下,向某浓度的草酸溶液中加入一定量某浓度的NaOH溶液,所得溶液中c(HC2O4-)=c(C2O42-),则此时溶液的pH=___(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是
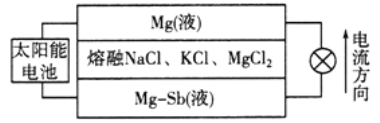
A. 放电时,Mg(液)层的质量减小
B. 放电时,正极反应为:Mg2++2e===Mg
C. 该电池充电时,Mg—Sb(液)层的质量增大
D. 该电池充电时,C1向下层方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
①干冰与CO2; ②白磷与红磷; ③![]() Cl与
Cl与![]() Cl;
Cl;
④液氯与氯水; ⑤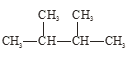 与
与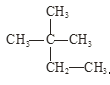 。
。
在上述各组物质中:
(1)互为同位素的是_____________;
(2)互为同素异形体的是__________,
(3)互为同分异构体的是_________;
(4)属于同种物质的是_________。(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com