
分析 (1)①浓H2SO4的物质的量浓度c=$\frac{1000ρω}{M}$;
②根据溶液稀释前后物质的量不变即c(稀)V(稀)=c(浓)V(浓)计算所需浓硫酸的体积;根据配制步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作选择仪器;
(2)慢慢滴入0.1000mol/L的硫酸溶液18.60ml时,硫酸的物质的量为0.001860mol,测得溶液正好显中性,说明只有溶质Na2SO4生成,其物质的量为0.001860mol,设20.00ml待测液中NaOH、Na2CO3的物质的量分别为xmol、ymol,根据钠守恒:xmol+ymol×2=0.001860mol×2以及40x+106y=2.000g×$\frac{20mL}{250mL}$解出NaOH、Na2CO3的物质的量,然后求出氢氧化钠的物质的量浓度以及质量百分数;
①根据上述计算结果分析;
②根据溶质的物质的量和溶液的体积引起变化,利用c=$\frac{n}{V}$分析.
解答 解:(1)①浓H2SO4的物质的量浓度c(H2SO4)=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L;
故答案为:18.4;
②根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250ml×2.0mol/L,解得:x≈27.2,所以量取的浓硫酸体积是27.2mL;配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到250ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为玻璃棒、烧杯、胶头滴管、量筒、250mL容量瓶,则缺少仪器250mL容量瓶;
故答案为:27.2;250mL容量瓶;
(2)慢慢滴入0.1000mol/L的硫酸溶液18.60ml时,硫酸的物质的量为0.001860mol,测得溶液正好显中性,说明只有溶质Na2SO4生成,其物质的量为0.001860mol,设20.00ml待测液中NaOH、Na2CO3的物质的量分别为xmol、ymol,根据钠守恒:xmol+ymol×2=0.001860mol×2以及40x+106y=2.000g×$\frac{20mL}{250mL}$,解得:x=0.00286mol、y=0.00043mol,氢氧化钠的质量为0.00286mol×40g/mol=0.1144g,物质的量浓度$\frac{0.00286mol}{0.02L}$=0.143moL/mol,样品中NaOH的质量百分数为$\frac{0.1144g}{2.000g×\frac{20.00ml}{250ml}}$×100%=71.25%;
故答案为:0.143;71.25%;
①由上述计算结果可知证明关于“部分变质”的推测,等质量的KOH中和硫酸的体积小于等质量的NaOH中和硫酸的体积,所以导致滴入的硫酸体积偏小,Na2CO3的物质的量偏大,氢氧化钠的物质的量偏大,质量百分数变大;
故选B.
②A.在称量时,把氢氧化钠样品放在称量纸上进行称量,氢氧化钠具有吸湿性,易潮解,溶质的物质的量偏小,根据c=$\frac{n}{V}$分析,氢氧化钠浓度减小,质量百分数偏小,故A正确;
B.在溶解过程中,少量液体溅出,溶质的物质的量偏小,根据c=$\frac{n}{V}$分析,氢氧化钠浓度减小,质量百分数偏小,故B正确;
C.在转移过程中,烧杯和玻璃棒没有进行洗涤,溶质的物质的量偏小,根据c=$\frac{n}{V}$分析,氢氧化钠浓度减小,质量百分数偏小,故C正确;
D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线水平,溶质的物质的量偏小,根据c=$\frac{n}{V}$分析,氢氧化钠浓度减小,质量百分数偏小,故D正确;
故答案为:ABCD.
点评 本题主要考查一定物质的量浓度溶液的配制与物质含量的测定,比较基础,注意测定原理的掌握,难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.8 mol | B. | 3.6 mol | C. | 100 mol | D. | 200 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Cu2+、Cl-、SO${\;}_{4}^{2-}$一定能大量共存 | |
| B. | 加入金属钠有氢气产生的水溶液中:K+、Na+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$四种离子一定不能大量共存 | |
| C. | 银氨溶液中加入足量的盐酸:Ag(NH3)${\;}_{2}^{+}$+OH-+3H++Cl-=H2O+AgCl↓+2NH${\;}_{4}^{+}$ | |
| D. | pH=2的氯水加水稀释10倍,稀释后的氯水的pH=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
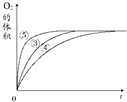 分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属质量(g) | 金属状态 | C(H2SO4)(mol/L) | V(H2SO4)(mL) | 溶液温度(℃) | 金属消失的时间(s) | |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 数据模糊 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 数据模糊 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 数据丢失 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
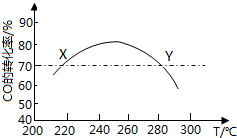 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )| A. | X、Y两点对应的CO正反应速率相等 | |
| B. | 合成二甲醚的正反应△H<0 | |
| C. | 反应温度应控制在260℃~280℃之间 | |
| D. | 选择合适催化剂,可以提高CO转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 由甘氨酸、丙氨酸形成的二肽有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 .
. .
.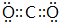 ,F与G形成的最简单的化合物的结构式为
,F与G形成的最简单的化合物的结构式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com