
 第四周期过渡元素易与C、H、N、O形成多种化合物.
第四周期过渡元素易与C、H、N、O形成多种化合物.| 5+1 |
| 2 |
| 2.870g |
| 143.5g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:
查看答案和解析>>
科目:高中化学 来源: 题型:


 也能发生类似V→VI 的反应,其化学反应方程式
也能发生类似V→VI 的反应,其化学反应方程式查看答案和解析>>
科目:高中化学 来源: 题型:
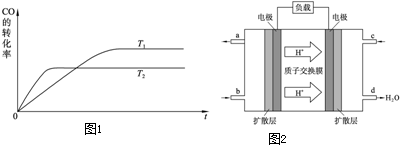
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石晶体中的最小碳环由6个碳原子构成 |
| B、Na2O2晶体中阴离子与阳离子数目之比为1?:1 |
| C、1 mol SiO2晶体中含2 mol Si-O键 |
| D、金刚石化学性质稳定,在高温下也不会和O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该晶体属于离子晶体 |
| B、晶体的化学式为Ba2O2 |
| C、该晶体结构与CsCl相似 |
| D、与每个Ba2+距离相等且最近的Ba2+共有8个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,向0.01mol?L-1NH4HSO4溶液中滴加 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B、0.4 mol/L HCl与0.1 mol/L NaAlO2等体积混合,所得溶液中:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
| C、Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| D、25℃时,pH=4.75、浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com