
【题目】将10.6 g Na2CO3固体溶于水配成100 mL溶液。
(1) Na2CO3的摩尔质量为__________g/mol。
(2) Na2CO3的物质的量为____________mol。
(3)该溶液中Na2CO3的物质的量浓度为________ mol/L。
(4)从该溶液中取出10 mL,其中含Na+的物质的量为________ mol。
(5)取出的10 mL该溶液加水稀释,稀释后溶液中Na2CO3的物质的量浓度为0.1 mol/L,稀释后溶液体积为________mL。
【答案】 106 0.1 1 0.02 100
【解析】(1)Na2CO3的相对分子质量是106,因此摩尔质量为106g/mol。(2)Na2CO3的物质的量为10.6g÷106g/mol=0.1mol。(3)该溶液中Na2CO3的物质的量浓度为0.1mol÷0.1L=1.0mol/L。(4)从该溶液中取出10 mL,其中Na+的浓度不变,是2.0mol/L,所以钠离子的物质的量为2.0mol/L×0.01L=0.02mol。(5)取出的10 mL该溶液加水稀释,稀释后溶液中Na2CO3的物质的量浓度为0.1 mol/L,根据稀释过程中溶质的物质的量不变可知稀释后溶液体积为![]() =100mL。
=100mL。


科目:高中化学 来源: 题型:
【题目】当1mol某气态烃与2mol Cl2发生加成反应时,分子中的不饱和碳原子全部转化为饱和碳原子,所得产物再与4mol Cl2进行取代反应后,生成只含C、Cl两种元素的化合物。则该气态烃是( )
A.乙炔B.乙烯C.丁二烯D.丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加罗常数为NA,下列说法正确的是
A. 常温常压下,11.2L甲烷中舍有的氢原子数为2NA
B. 标准状况下,19.2g二氧化硫中含有的氧原子数为0.3NA
C. 1molNa被完全氧化生成Na202,转移电子的数目为NA
D. 常温下,1L0.1mol/L MgCl2溶液中含Cl-数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,A与B反应可生成C和D,其能量变化如图:

(1)下列有关反应A+B===C+D的说法正确的是________。
A.反应前后原子的种类和数目一定不变
B.该反应若有热量变化,则一定是氧化还原反应
C.若该反应为放热反应,则不需要加热反应就一定能自发进行
D.反应物的总质量、总能量与反应产物的总质量、总能量均相等
(2)若H1<H2,则反应产物的总能量________(填“>”“<”或“=”)反应物的总能量,反应热Q________0(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【宣城市2017届第二次调研测试】抗痫灵(G)具有抗癫痫、抗惊厥、抗抑郁等功效,其合成路线如下图所示(某些反应条件和副产物已略):
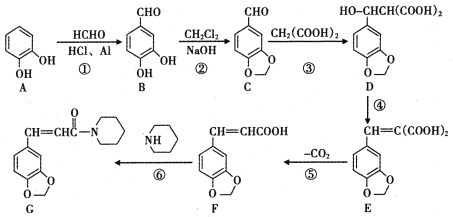
(1)A中含氧官能团名称是____;简述证明A含有该官能团的实验方法:_________。
(2)若以醛基为母体,则B的系统命名法的名称为_______;①~⑥的反应中属于加成反应的是____ (填序号)。
(3)芳香化合物H是C的同分异构体,H的相关信息如下:
a.可发生银镜反应; b.可与NaHCO3溶液反应生成气体;c.苯环上的一溴代物有2种,则H的结构简式为__________。
(4)写出反应⑥的化学反应方程式:_____________。
(5)( )的单体是薰衣草的调和香料,以苯甲醛(
)的单体是薰衣草的调和香料,以苯甲醛(![]() )为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)
)为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓硫酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
硫酸 化学纯(CP)(500 mL)
品名:硫酸 化学式:H2SO4
相对分子质量:98 密度:1.84 g·mL-1
质量分数:98%
(1)该浓硫酸中H2SO4的物质的量浓度为______________mol/L。
(2)某学生欲用上述浓硫酸和蒸馏水配制250 mL物质的量浓度为1.84mol/L的稀硫酸。他需要量取___________mL上述浓硫酸进行配制,需要的玻璃仪器除了烧杯、玻璃棒,50mL量筒,还有___________________________________。配制时,其正确的操作顺序是___________(用字母表示,每个字母只能用一次)。
A.用少量蒸馏水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡。
B.先在烧杯中加适量蒸馏水,再把量好的浓硫酸沿玻璃棒倒入烧杯中,搅拌均匀。
C.将已冷却的溶液沿玻璃棒注入容量瓶中。
D.将容量瓶盖紧,振荡,摇匀。
E.继续加水至离刻度线1-2厘米处,改用胶头滴管加水,使凹液面恰好与刻度线相切。
F.将配制好的溶液装进试剂瓶,并贴上标签。
(3)假设该同学取了50mL新配的稀硫酸,与1.0mol/L的Ba(OH)2溶液反应,当恰好沉淀完全时,发现实际用去Ba(OH)2溶液的体积比理论需要的少,则可能的原因是______________。
A.用量筒量取浓硫酸时操作太慢,吸收了空气中的水蒸气
B.量取浓硫酸时,俯视量筒刻度线
C.配制溶液时,俯视容量瓶刻度线
D.在烧杯中稀释浓硫酸后立刻转移到容量瓶中
E.装进试剂瓶时,有少量溶液洒出瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)下列实验方案适用于在实验室制取所需SO2的是_______。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 硫化氢在空气中燃烧 D. 高温煅烧硫铁矿
(2)装置C的作用是______________________________。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、________、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(4)①写出SO2与FeCl3溶液反应的离子方程式:______________________________;
②请设计实验方案检验反应后A中Fe2+生成______________________________;
③本实验中能表明SO2的还原性比I-的还原性强的现象是__________________,其反应的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【河南省2017届诊断卷(A)】金属钛(Ti)具备硬度大、熔点高、耐酸碱腐蚀,被广泛用于航天航空、医疗卫生及日常生活中。以钛铁矿(主要成分FeTiO3)为主要原料冶炼金属钛的生产工艺如下:

回答下列有关问题:
(l)钛铁矿精矿中加入硫酸除生成TiOSO4外,还生成水和硫酸亚铁,则FeTiO3中Ti的化合价为__价。
(2)流程图中加入“铁屑”的目的是_______(填字母)。
A.防Fe2+氧化 B.与Fe3+反应 C.防Fe2+水解 D.防Fe3+水解
(3)溶液I经“操作a”可得固体副产品甲,则操作a的名称包括冷却、________,副产品甲的化学式是______。
(4)已知钛酸难溶于水,其化学式为H2TiO3。则向溶液II中加入水,加热时的化学方程式为_____。
(5)操作b为煅烧,则中间产品乙的化学式为_______。
(6)已知气体丙是一种有毒气体,写出中间产品乙与氯气、焦炭反应的化学方程式______。
(7)在800~1000℃时,应用如图装置电解TiO2也可制得海绵钛。装置图中e 是电源的_____极,阴极的电极反应式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017天津]用沉淀滴定法快速测定NaI等碘化物溶液中c(I),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L1 AgNO3溶液(过量),使I完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000 mol·L1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有__________。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是___________________________。
(3)滴定应在pH<0.5的条件下进行,其原因是___________________________________。
(4)b和c两步操作是否可以颠倒________________,说明理由________________________。
(5)所消耗的NH4SCN标准溶液平均体积为_____mL,测得c(I)=_________________ mol·L1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为________________________。
(7)判断下列操作对c(I)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果_______________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com