
| |||||||||||||||
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
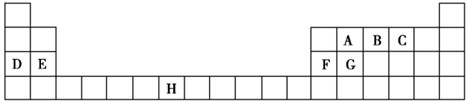
查看答案和解析>>
科目:高中化学 来源: 题型:
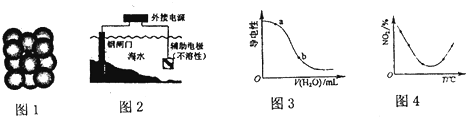
| A、图1为某金属单质晶体中原子的堆积方式,则其晶胞构型为体心立方 | B、图2为钢闸门的防腐原理示意图,则钢闸门应与电源的正极相连 | C、图3表示CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b | D、图4表示在容积相同的恒容密闭容器中,等量的N02在不同温度下反应:2N02(g)?N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O |
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1) 太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式__________,它位于周期表____________区。
(2) 富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为________;1 mol C60分子中σ键的数目为____________个。
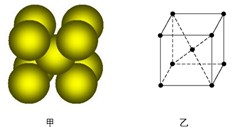
(3) Cu单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中Cu原子的配位数为____________,一个晶胞中Cu原子的数目为________。
(4) Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是________.________。
(5) 下列说法正确的是________。
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔.沸点越高
查看答案和解析>>
科目:高中化学 来源:2012年北京高考模拟系列试卷一理综部分(解析版) 题型:填空题
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。

(1) 太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式__________,它位于周期表____________区。
(2) 富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为________;1 mol C60分子中σ键的数目为____________个。

(3) Cu单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中Cu原子的配位数为____________,一个晶胞中Cu原子的数目为________。
(4) Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是________.________。
(5) 下列说法正确的是________。
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔.沸点越高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com