
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用. | / |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤. | / |
| 步骤3:取少量步骤2得到的滤渣,加入盐酸. | |
| 步骤4: | |
| 步骤5: |
分析 (1)硫酸型酸雨由SO2形成,溶液中可能含有SO2或H2SO3;
(2)酸雨中可能含有硫酸、亚硫酸、盐酸,根据对应的性质和提供的药品可设计验证方案,其中硫酸可用氯化钡检验,盐酸可用硝酸银检验,亚硫酸可用品红检验;
(3)碘水具有强氧化性,能氧化橡胶管,选择酸式滴定管,滴加碘水,碘和亚硫酸发生氧化还原反应,结合反应的方程式计算.
解答 解:(1)硫酸型酸雨由SO2形成,SO2与水反应生成H2SO3,H2SO3被氧化生成H2SO4,溶液中可能含有SO2或H2SO3,
故答案为:SO2(或H2SO3);
(2)酸雨中可能含有硫酸、亚硫酸、盐酸,根据对应的性质和提供的药品可设计验证方案,其中硫酸可用氯化钡检验,盐酸可用硝酸银检验,亚硫酸可用品红检验,可设计实验如下:
步骤1:取适量酸雨于A、B两支洁净试管中,待用;
步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤;
步骤3:取少量步骤2得到的滤渣加入盐酸,若滤渣不完全溶解,则酸雨中含有硫酸;
步骤4:取适量步骤2得到的滤液,先加入过量的硝酸,然后加入AgNO3溶液,若产生白色沉淀,则酸雨中含有盐酸;
步骤5:往B试管中加入少量品红溶液,振荡,若品红溶液褪色,则酸雨含有亚硫酸(或二氧化硫),
故答案为:
| 实 验 步 骤 | 预期现象和结论 |
| 步骤3: | 若滤渣不完全溶解,则酸雨中含有硫酸 |
| 步骤4:取适量步骤2得到的滤液,先加入过量的硝酸,然后加入AgNO3溶液 | 若产生白色沉淀,则酸雨中含有盐酸 |
| 步骤5:往B试管中加入少量品红溶液,振荡 | 若品红溶液褪色,则酸雨含有亚硫酸(或二氧化硫) |
点评 本题考查环境污染知识,侧重于学生的分析能力、实验能力和计算能力的考查,为高考高频考点,注意把握物质的性质以及实验的方法和原理,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 若质量相等,则质子数相等 | B. | 若原子数相等,则分子数相等 | ||
| C. | 若分子数相等,则密度相等 | D. | 若物质的量相等,则密度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
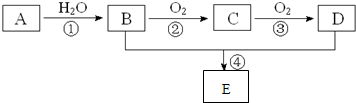
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+,CO32-,Cl-,Na+ | B. | Al3+,NH4+,OH-,NO3- | ||
| C. | Ag+,Br-,SO42-,K+ | D. | NO3-,Na+,H+,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
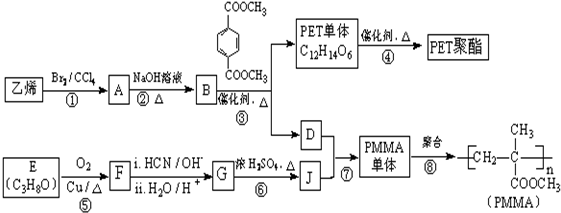
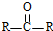 $→_{H_{2}O/H+}^{i.HCN/OH-}$
$→_{H_{2}O/H+}^{i.HCN/OH-}$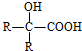 (R、R′代表烃基)
(R、R′代表烃基)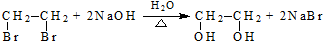
 .
.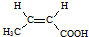 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com