

分析 (1)CO2和NH3合成CO(NH2)2,根据元素守恒可知,同时还有H2O生成,配平书写方程式;
(2)由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行;设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为0.6a,根据方程式计算转化的NH3的物质的量,再根据转化率定义计算;
(3)①根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律,结合本题图中的电极产物H2和Cl2可以判断出A为电源的正极,B为电源的负极;
②由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl;
③阴极反应为:6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑);
阳极反应为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl;
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
由上述反应式可以看出,转移6 mol e-时,阴极产生3 mol H2,阳极产生1 mol N2和1 mol CO2,根据n=$\frac{V}{Vm}$计算两极产生的气体的物质的量,利用气体中各组分的比例关系,计算n(N2)=n(CO2),再根据方程式计算尿素的物质的量,根据m=nM计算尿素的质量.
解答 解:(1)CO2和NH3合成CO(NH2)2,根据元素守恒可知,同时还有H2O生成,化学方程式为:
2NH3+CO2$\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2+H2O,故答案为:2NH3+CO2$\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2+H2O;
(2)由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率,设CO2的初始物质的量为a,则NH3的初始物质的量为2.5a,由图可知,CO2的转化率为60%,故转化的二氧化碳为a×60%=0.6a,根据方程式可知,转化的NH3的物质的量为0.6a×2=1.2a,故平衡时氨气的转化率定$\frac{1.2a}{2.5a}$×100%=48%,
故答案为:小于;48%;
(3)①由图可知,左室电极产物为Cl2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源
的负极,故答案为:B;
②由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,
故答案为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl;
③阴极反应为6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑)
阳极反应为6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应式可以看出,转移6 mol e-时,阴极产生3 mol H2,阳极产生1 mol N2和1 mol CO2,故电解收集到的13.44 L气体,物质的量为$\frac{13.44L}{22.4L/mol}$=0.6mol,即n(N2)=n(CO2)=0.6mol×$\frac{1}{5}$=0.12 mol,
根据方程式CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl可知生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,其质量为:m[CO(NH2)2]=0.12 mol×60 g•mol-1=7.2 g.
故答案为:不变,7.2.
点评 考查化学平衡的计算、电解池原理与有关计算,难度较大,(3)中关键注意观察电极产物,判断发生的反应,注意根据方程式判断左室中PH值的变化.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:实验题
Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为__________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
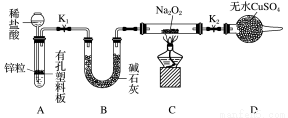
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是_____________________。
③设置装置D的目的是___________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 NaOH溶液 | B. | 2 mol•L-1HCl溶液 | ||
| C. | 2 mol•L-1NaCl溶液 | D. | 硅酸胶体(胶粒带负电荷) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是
A.H2SO4 B.HCl C.NaOH D.NaNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com