

分析 首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积,据此确定溶液中n(Mg2+):n(Al3+),据此计算解答.
解答 解:首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积为10mL×3=30mL,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,则沉淀Mg2+消耗的氢氧化钠溶液的体积为50mL-30mL=20mL,则n(Mg2+):n(Al3+)=$\frac{1}{2}$×20mL:$\frac{1}{3}$×30mL=1:1,故原来混合溶液中Al2(SO4)3和MgSO4的物质的量之比为$\frac{1}{2}$:1=1:2,故答案为:1:2.
点评 本题考查镁铝化合物性质、混合物的有关计算,难度中等,根据清楚图象反应过程是解题关键.


科目:高中化学 来源: 题型:解答题
 如图,甲、乙为相互串联的两个电解池,请回答下列问题:
如图,甲、乙为相互串联的两个电解池,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
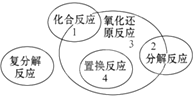 四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$ 2HCl | ||
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | D. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol B和3 mol C | |
| B. | 2 mol A、1mol B和1 mol He(不参加反应) | |
| C. | 1 mol B和1 mol C | |
| D. | 2 mol A、3mol B和3 mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$\stackrel{浓硝酸}{→}$ Cu(NO3)2 | B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{硝酸银溶液}{→}$Cu(NO3)2 | D. | Cu $\stackrel{氧气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com