
| A. | 该反应的氧化剂是ClO- | |
| B. | 该反应中有两种离子生成 | |
| C. | 参加反应的氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 该反应消耗1mol还原剂时,转移的电子为3 mol |
分析 具有氧化性的ClO-为反应物,则N元素化合价发生升高,所以NH4+应是反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,以此解答该题.
解答 解:A.Cl元素的化合价降低,则反应的氧化剂是ClO-,故A正确;
B.反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,所以该反应中有两种离子生成,故B正确;
C.由反应可知,氧化剂与还原剂的物质的量之比为3:2,故C错误;
D.N元素的化合价由-3价升高为0,NH4+为还原剂,则消耗1mol还原剂,转移电子3mol,故D正确.
故选C.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 金属性Na>Mg>Al | B. | 原子半径大小:S>Cl>F | ||
| C. | 稳定性 PH3>H2S>HF | D. | 碱性强弱:KOH>NaOH>LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷有3种同分异构体 | |
| B. | 己烷共有5种同分异构体,它们的熔、沸点各不相同 | |
| C. | “可燃冰”的主要成分是甲烷和水 | |
| D. | 多氯代甲烷常为有机溶剂,其中分子结构为正四面体的是四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
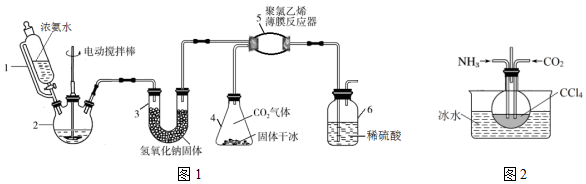
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
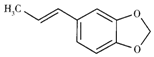 黄樟脑(结构简式如图)可作为洋茉莉和香兰素的原料,能除肥皂的油脂臭,常作廉价的香料使用于皂用香精中.下列有关叙述正确的是( )
黄樟脑(结构简式如图)可作为洋茉莉和香兰素的原料,能除肥皂的油脂臭,常作廉价的香料使用于皂用香精中.下列有关叙述正确的是( )| A. | 黄樟脑属于酯、烯烃、芳香族化合物 | |
| B. | 黄樟脑分子中最少有9个碳原子共面 | |
| C. | 黄樟脑与H2、Br2均能发生加成反应 | |
| D. | 与黄樟脑互为同分异构体且含苯环、羧基及一个支链的结构有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸与足量金属Na反应生成生成lmolH2 | |
| B. | 1mol苹果酸可与3molNaOH发生中和反应 | |
| C. | 苹果酸中能发生酯化反应的官能团有2种 | |
| D. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分离碘酒中的碘和酒精 | |
| B. |  分离沸点相差较大的互溶混合物 | |
| C. |  制取氯化镁固体 | |
| D. |  检验蔗糖与浓硫酸反应产生的二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
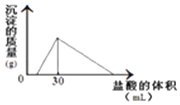 将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为2.016L(标准状况)
将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为2.016L(标准状况)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸溶解碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$NO2 | |
| C. | 生产聚丙烯塑料:nCH=CH-CH3→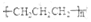 | |
| D. | 制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com