
(12分)硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下:
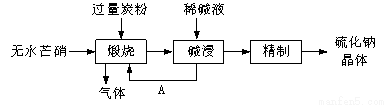
(1)若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是 。
(3)常温下,取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= mol·L-1。
(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是:x= ,pH控制在 范围。

②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
(5)常温下利用Fe2+、Fe3+的相互转化,可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(1)3Na2SO4+8C 3Na2S+4CO2↑+4CO↑(2分)
3Na2S+4CO2↑+4CO↑(2分)
(2)热水会促进Na2S水解,而稀碱液能抑制Na2S水解(2分)(3)4×10-36 mol·L-1(2分)
(4)①12 (1分) 9~10 (1分) ②SO42-、Cl-(共2分,各1分)
(5)2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42- + 4H+ (2分)
【解析】
试题分析:(1)若煅烧所得气体为等物质的量的CO和CO2,则根据原子守恒可知煅烧时发生的总的化学反应方程式为3Na2SO4+8C 3Na2S+4CO2↑+4CO↑。
3Na2S+4CO2↑+4CO↑。
(2)硫化钠是强碱弱酸盐,硫离子水解溶液显碱性,热水会促进Na2S水解,而稀碱液能抑制Na2S水解,所以上述流程中采用稀碱液比用热水更好。
(3)根据硫化铜和氢氧化铜的溶度积常数可知c(Cu2+)·c(S2—)=8.8×10-36、c(Cu2+)·c(OH—)2=2.2×10-20,所以溶液中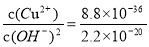 。又因为pH=4,则c(OH—)=1×10-10mol/L,所以溶液中c(S2—)=4×10-36 mol·L-1。
。又因为pH=4,则c(OH—)=1×10-10mol/L,所以溶液中c(S2—)=4×10-36 mol·L-1。
(4)①根据图像可知在pH相等的条件下x=12时汞的去除率最高。而在x值相等的条件下pH在9~10之间时汞的去除率最高。即为使除汞效果最佳,应控制的条件是:x=12,pH控制在9~10范围。
②次氯酸钠与硫化钠的物质的量之比时0.002×2:0.001×1=4:1,次氯酸钠的还原产物是氯化钠,则根据电子得失守恒可知硫化钠的氧化产物是硫酸钠,因此处理后的废水中所含的主要阴离子有SO42-、Cl-。
(5)其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则利用总反应式减去该反应即可得到另一反应的离子方程式为2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42- + 4H+。
考点:考查物质制备以及工业废水处理的有关实验方案设计与探究


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源:2014-2015陕西岐山县高一上学期期末质量检测化学试卷(解析版) 题型:选择题
下列关于钠的叙述中,不正确的是
A.钠燃烧时发出黄色的火焰 B.钠燃烧时生成氧化钠
C.钠有很强的还原性 D.钠原子的最外层只有一个电子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(15分)近年来,为提高能源利用率,西方提出共生系统。特指为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 。用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:

①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C CaS+4CO↑
CaS+4CO↑
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:选择题
由氧化铜和氧化铁组成的混合物a g,加入2 mol·L-1的稀硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为
A. 1.6a g B.(a-1.6) g C.(a-3.2) g D.无法计算
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
(12分)由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了。全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、 H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe3+的电子排布式 。
(2)与CO2互为等电子体的一种离子为 (填化学式)。
(3)NH3分子中氮原子的杂化轨道类型是 。
(4)1 mol CH3COOH中含有的σ键的数目为 。
(5)TiO2的天然晶体中,最稳定的一种晶体结构如图,黑球表示 原子。

(6)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物(如上图),该化合物中Fe2+与环戊二烯基离子之间以 相结合(填字母)。
a.离子键
b.金属键
c.配位键
d.氢键
e.范德华力
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀
B.0.1 mol·L-1氨水加水稀释后,溶液中 的值减小
的值减小
C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用对应关系不正确的是
A.锂质量轻、比能量大,可用作电池负极材料
B.SO2具有漂白性,可用作熏蒸食用粉丝使其增白
C.酒精是良好的有机溶剂,可洗去皮肤表面沾有的苯酚
D.Al(OH)3受热分解吸收大量的热,生成耐高温的Al2O3,可用作阻燃剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足下图所示转化关系的是

甲 | 乙 | 丙 | 戊 | |
① | NH3 | O2 | NO2 | H2 |
② | Fe | H2O | Fe3O4 | Al |
③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
④ | Na2O2 | CO2 | O2 | Na |
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省南阳市高三上学期期末理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列叙述中正确的有几项
①78g Na2O2与足量的二氧化碳反应,转移电子数目为NA
②足量Fe与标况下22.4L的氯气反应转移电子数目为2NA
③常温常压下16gO2与O3混合气中含有氧原子数目为NA
④0.2mol/LNaOH溶液中OH-的数目为0.2NA
A.1项 B.2项 C.3项 D.4项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com