
| A | B | C | |
| 分类标准 | 含氧酸 | 分散系 | |
| 不属于该类别的物质 | Na2CO3 |
| V |
| Vm |
| N |
| NA |
| ρ1 |
| ρ2 |
| M1 |
| M2 |
| 18g |
| 18g/mol |
| 6.72L |
| 22.4L/mol |
| 3.01×1023 |
| 6.02×1023mol-1 |
| 3.4g |
| 17g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
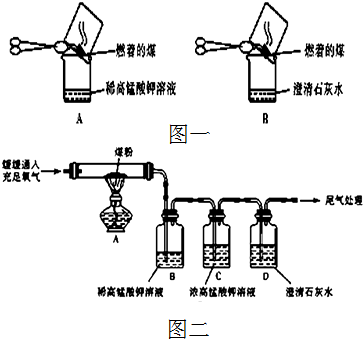
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第Ⅳ族氢化物沸点:CH4<SiH4,则第Ⅴ族氢化物沸点:NH3<PH3 |
| B、第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
| C、可电解熔融氯化镁制取金属镁,则也能用电解熔融氯化铝制取金属铝 |
| D、晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C处分别充入等质量的X、H2、Y三种气体,当隔板静止时,A、C内的气体密度相等,下列说法正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C处分别充入等质量的X、H2、Y三种气体,当隔板静止时,A、C内的气体密度相等,下列说法正确的是( )| A、X的相对分子质量等于Y的相对分子质量 |
| B、X的相对分子质量比Y的相对分子质量小 |
| C、气体的体积:V(X)>V(H2)>V(Y) |
| D、物质的量:n(X)<n(H2)<n(Y) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com