
| A. | 最高价氧化物的水化物显酸性 | B. | 非金属性比溴强 | ||
| C. | 原子序数为24 | D. | 氢化物比H2S稳定 |
分析 A.同主族从上到下元素的最高价氧化物的水化物碱性逐渐增强,酸性减弱;
B.同周期从左向右元素的非金属性逐渐增强;
C.同主族相邻的3、4两周期元素原子序数差18;
D.同主族从上到下元素的氢化物稳定性逐渐减弱.
解答 解:A.硒(Se)和硫同主族,硫的最高价氧化物的水化物硫酸是强酸性的,硒的最高价氧化物的水化物也显酸性,故A正确;
B.Se与Br同周期,从左向右元素的非金属性逐渐增强,则非金属性比溴弱,故B错误;
C.同主族相邻的3、4两周期元素原子序数差18,硫是16号,所以硒是34号,即原子序数为34,故C错误;
D.非金属性S>Se,则氢化物不如H2S稳定,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置和性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
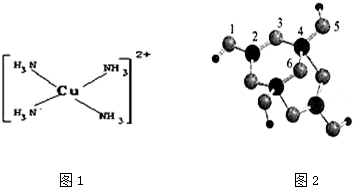
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
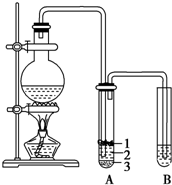 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (b-a-c)kJ | B. | (3a-b+c )kJ | C. | (a-3b+c)kJ | D. | (b-3a-c)kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
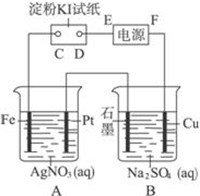 室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))
室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 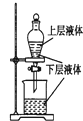 提取海带中的碘 | B. | 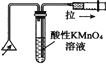 检验火柴燃烧产生的SO2 | ||
| C. | 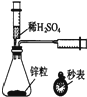 测定一定时间内生成H2的反应速率 | D. | 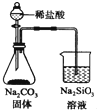 证明非金属性Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 苹果酸在一定条件下能跟乙酸发生酯化反应 | |
| B. | 苹果酸在一定条件下能与金属钠反应 | |
| C. | 苹果酸在一定条件下能跟乙醇发生酯化反应 | |
| D. | 1 mol苹果酸与Na2CO3溶液反应最多消耗3 mol Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取28.6 g Na2CO3•10H2O,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 称取 28.6 g Na2CO3•10H2O,加入100 mL蒸馏水,搅拌、溶解 | |
| C. | 转移时将烧杯中溶液直接倒人容量瓶中 | |
| D. | 定容后,塞好瓶塞,反复倒转、摇匀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com