
(14分)硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:
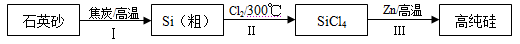
(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是 。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是 。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应1:400℃~756℃ ,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0
反应2:756℃~907℃ ,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(g) ΔH2 <0
Si(s) + 2ZnCl2(g) ΔH2 <0
反应3:907℃~1410℃,SiCl4(g) + 2Zn(g)  Si(s) + 2ZnCl2(g) ΔH3 <0
Si(s) + 2ZnCl2(g) ΔH3 <0
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是 。
③ 已知Zn(l)==Zn(g) ΔH = +116 KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:2014-2015学年上海市高三第一学期第一次月考化学试卷(解析版) 题型:选择题
卢瑟福发现铀产生的a、b、c三种射线在电场中有如图所示情况。下列认识错误的是
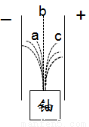
A.c射线是带负电荷的电子流
B.b射线是不显电性的波长很短的电磁波
C.a射线是氦原子——α粒子
D.在科学家的不懈努力下人类打开了原子结构的大门
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) △H=-273kJ·mol-1
②NO2-(aq)+1/2O2(g)=NO3-(aq) △H=-73kJ·mol-1
下列说法正确的是( )
A.1mol的NH3和1mol的NH4+都有10×6.02 ×1023个质子
B.室温下,NH4NO2溶液呈酸性,则说明Ka(HNO2)< Kb(NH3·H2O)
C.NH4+(aq)+2O2(g) NO3—(aq)+2H+(aq)+H2O(l);△H= - 346kJ/mol
D.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱
查看答案和解析>>
科目:高中化学 来源:2016届山东省齐鲁教科研协作体19所高三上学期第一次联考化学试卷(解析版) 题型:选择题
目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放食盐水,另一层存放镁和铁的混合物,使用时打开隔离层,食物即可被快速加热。下列对其工作原理分析不正确的是
A.打开隔层后,形成了由食盐水、镁和铁构成的原电池
B.金属镁发生了氧化反应
C.铁是该原电池的负极
D.反应中涉及化学能、电能和热能的转化
查看答案和解析>>
科目:高中化学 来源:2016届全国推荐高三联考(二)化学试卷(解析版) 题型:填空题
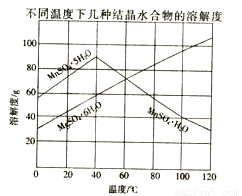
(12分) 软锰矿(主要成分MnO2,含Fe,Al2O3 ,MgO杂质)的水悬浊液与烟气中的SO2反应可制备MnSO4·H2O,MnO2与SO2反应的化学方程式为MnO2 +SO2=MnSO4。已知下列信息:
室温下几种氢氧化物的溶度积

回答下列问题:
(1)质量为17.40 g纯净MnO2最多能氧化 L(标准状况) SO2。
(2)悬浊液吸收烟气后,Fe首先转化为Fe2+进入溶液,然后被 氧化为Fe3+;要证明溶液中存在Fe3+,可选择的试剂是 (填标号)。
a.KMnO4溶液 b.KCl溶液 c.KSCN溶液 d.KNO3溶液
(3)室温下,将吸收液过滤,在滤液中加入CaCO3,可除去MnSO4溶液中的Fe3+、Al3+,原因是 。
(4)从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三第一次月考化学试卷(解析版) 题型:填空题
(10分)某废水中可能含有下列离子中的若干种:
Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水一定含有的离子是________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是___________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1: 4,其离子方程式为Al+NO3-+OH-―→AlO2-+NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO3-,要消耗铝________g。
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。下列处理措施和方法中正确的是________。
选项 | 污染物 | 处理措施 | 方法类别 |
A | 碱性的废水 | 用CO2中和 | 化学法 |
B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省张掖市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液pH=8,则混合溶液中水电离产生的c(OH-)=110-8
B.室温下,CH3COONa和CaCl2的混合溶液:c (Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-)
C.恒容密闭容器中进行反应2A2(g)+B2(g) 2A2B(g) ,达到化学平衡后,加热会使逆反应速率大于正反应速率
2A2B(g) ,达到化学平衡后,加热会使逆反应速率大于正反应速率
D.常温下,pH=11的氨水和pH=1的盐酸等体积混合,恰好完全反应,则混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=5×10-4mol/L
查看答案和解析>>
科目:高中化学 来源:2016届安徽省江南十校新高三摸底联考化学试卷(解析版) 题型:选择题
下列有关铝及其化合物的性质叙述正确的是
A.等质量的铝分别与足量的盐酸和足量的氢氧化钠溶液反应制得等质量的氢气
B.向氯化铝溶液中滴加过量氨水,最终得到澄清溶液
C.常温下铝、铁都可以与浓硝酸反应制得大量的NO2
D.FeC13溶液加热蒸干得到无水氯化铁晶体
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省双鸭山市高三上第一次月考化学试卷(解析版) 题型:选择题
在水溶液中能大量共存的一组离子是
A.NH+、Na+、Cl-、SO42- B.K+、Mg2+、OH-、NO3-
C.H+、Ca 2+、SiO32-、NO3- D.K+、Al3+、ClO-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com