
| A. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4 NH3•H2O=4NH4++AlO2-+2H2O | |
| C. | 向次氯酸钙溶液中通入少量的二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| D. | 碳酸钠溶液中加入过量的苯酚: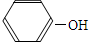 +CO32-= +CO32-= +HCO3- +HCO3- |
分析 A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合反应生成碳酸钡、一水合氨和水;
B.不符合反应客观事实;
C.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
D.苯酚酸性强于碳酸氢钠,弱于碳酸,二者反应生成苯酚钠和碳酸氢钠.
解答 解:A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合,离子方程式:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O,故A正确;
B.氯化铝溶液中加入过量的氨水生成氢氧化铝和氯化铵,离子方程式:Al3++3 NH3•H2O═Al(OH)3+3NH4+,故B错误;
C.向次氯酸钙溶液中通入少量的二氧化硫,离子方程式:Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+,故C错误;
D.苯酚酸性强于碳酸氢钠,弱于碳酸,二者反应生成苯酚钠和碳酸氢钠,离子方程式: +CO32-=
+CO32-= +HCO3-,故D正确;
+HCO3-,故D正确;
故选:AD.
点评 本题考查了离子方程式的书写,为高频考点,把握发生反应及离子反应的书写方法为解答的关键,注意离子方程式书写应遵循客观事实,题目难度不大.


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 11.2L,22.4L | B. | 15.68L,17.92L | C. | 13.44L,20.16L | D. | 16.8L,16.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、K+、SO42-、Cl- | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Ag+、K+、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t(℃) | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 38.0 | 55.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(浓)+C | B. | Fe2O3+Al | C. | HNO3(浓)+C | D. | Fe2O3+CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用镊子取用托盘天平的砝码 | B. | 点燃氢气体之前,应该先检验纯度 | ||
| C. | 用烧杯溶解氯化钠固体 | D. | 尝实验室的蔗糖是否有甜味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某气体通入品红溶液中,品红溶液褪色,该气体不一定是SO2 | |
| B. | 因为亚硫酸的酸性强于碳酸,所以硫的非金属性比碳强 | |
| C. | 有些化学反应不属于化合、分解、置换、复分解中的任何一种反应 | |
| D. | 依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com