
| A、化石燃料的燃烧、垃圾焚烧产生的烟尘以及道路和建筑施工的扬尘都是形成雾霾天气的原因之一 |
| B、调整工业能源结构,研制开发燃料电池汽车,能有效地减少PM2.5的污染 |
| C、PM2.5粒径小,富含大量的有毒、有害物质,佩戴口罩就能防止PM2.5的污染,因此不必治理 |
| D、在雾霾天气中,开车打开车灯时从侧面可能看到一条光亮的通路 |


科目:高中化学 来源: 题型:
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、氧化性由强到弱顺序为KIO3>KClO3>Cl2>I2 |
| C、反应②中还原剂与氧化剂的物质的量之比为6:1 |
| D、③中1mol还原剂反应则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) |
| B、c(HC2O4-)+c(C2O42-)=0.1mol/L |
| C、c(C2O42-)>c(H2C2O4) |
| D、c(K+)=c(H2C2O4)+c(HC2O4-)+2c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 |
| B、酸根离子中不可能含有金属元素 |
| C、酸性氧化物在一定条件下,都可以与碱反应生成盐和水 |
| D、还原产物只有还原性,氧化产物只有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同条件下,2mol SO2(g)和1mol O2(g)所具有的能量小于2mol SO3(g)所具有的能量 |
| B、将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C、增大压强或升高温度,该平衡都向逆反应方向移动 |
| D、将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2mol SO2(g)被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①③④⑥ |
| C、①②④ | D、②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L己烷中共价键数目为18NA |
| B、常温下,0.1mol乙烷与乙烯混合气体中所含碳原子数为0.2NA |
| C、2.24L乙烯中所含σ键数为0.2NA |
| D、1mol苯分子中共有6NA原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
| B、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) |
| C、S(s)+O2(g)═SO2(g);△H=-269.8kJ/mol(反应热) |
| D、2CH3OH(l)+3 O2(g)=2CO2(g)+4H2O(l)△H=-1452 kJ?mol-1(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:
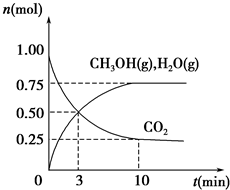 如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题.
如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题.温度(K) CO2转化率/(%)
| 500 | 600 | 700 | 800 | ||
| 1.5 | 45 | 33 | 20 | 12 | ||
| 2 | 60 | 43 | 28 | 15 | ||
| 3 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com