
某课外活动小组拟用下列实验装置探究氯气与氨气之间的反应。其中A、B分别为氨气和氯气的发生装置;C为纯净、干燥的氯气与氨气反应的装置。表中的三个备选装置则是为完成实验必须的设备。各装置之间用橡胶管连接。请回答下列问题:

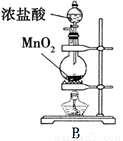
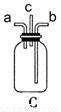
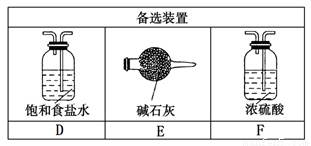
(1).若NH3从左向右流动,Cl2从右向左流动,则装置的正确连接顺序为:A、_____、_____、_____、_____、B(请将C、D、E、F填在相应的横线上)
(2)正确连接装置后,如何检验A装置的气密性____________________________________。
(3)装置A中的烧瓶内试剂可选用________(选填以下选项的代号)。
A.烧碱 B.浓硫酸 C.生石灰 D.五氧化二磷
(4)装置B中发生反应的离子方程式是______________________________________。
(5)反应开始后,C装置内产生白烟,试写出C内的化学反应方程式___________________。
(6)为使NH3与Cl2的混合更充分,Cl2应从C装置的______口进入(填“a”、“b”、“c”)
(7)该装置是否还存在着缺陷______(填“是”、“否”),如果有,其相应的改进措施是________________________________(如果没有,则不填该空)。
(1)E﹑C﹑F﹑D(2分,作为一个整体评分)
(2)用止水夹夹住AE之间橡胶管,打开A装置分液漏斗瓶塞与活塞,向其中注水。若过一段时间后,液面不再下降,说明气密性完好,反之,则气密性差。(2分)
(3)A﹑C(2分);只选A或C(1分)
(4)MnO2 + 4H+ + 2Cl- Cl2↑ + Mn2+ + 2H2O(2分)
Cl2↑ + Mn2+ + 2H2O(2分)
(5)8NH3 + 3Cl2 = N2 + 6NH4Cl
(6)a (1分)
(7)是(1分) 将导气管C伸入装有NaOH的洗气瓶中,将尾气洗涤后排空。(1分)
【解析】
试题分析:(1)用碱石灰干燥氨气,用饱和食盐水除去氯化氢,然后用浓硫酸干燥氯气;
(2)用止水夹夹住AE之间橡胶管,打开A装置分液漏斗瓶塞与活塞,向其中注水。若过一段 时间后,液面不再下降,说明气密性完好,反之,则气密性差;
(3)装置A中的烧瓶内试剂的作用是吸水放热使氨气放出,而B会和氨水反应,D不溶于氨水, 溶于水生成剧毒的偏磷酸,所以选AC;
(4)由装置中药品可知B中发生浓盐酸与二氧化锰的反应生成氯气;
(5)氯气和氨气反应生成氯化铵;
(6)氯气的密度大;
(7)因氯气、氨气都污染环境,不能直接排放,则缺少尾气处理装置;
考点:氯化铵实验。


科目:高中化学 来源:学习周报 化学 人教课标高二版(选修5) 2009-2010学年 第24期 总第180期 人教课标版(选修5) 题型:058
某课外活动小组设计如下图所示装置制取溴苯,并探究苯与溴发生反应的反应类型.该反应需要用
FeBr3作催化剂.实验时,把苯和少量溴放在烧瓶里,同时加入少量铁屑,立即用带导管的瓶塞塞紧瓶口.请回答下
列问题:

(1)写出铁与溴反应的化学方程式:________.
(2)写出溴与苯反应的化学方程式:________.实验过程中可观察到烧瓶中的反应液微沸,说明该反应是________热反应(填“放”或“吸”).
(3)锥形瓶中的溶液是硝酸酸化的AgNO3溶液.实验时可看到锥形瓶中有淡黄色浑浊生成.该小组同学认为,这并不能证明苯与溴发生的是取代反应,你认为他们的原因是________.
(4)实验小组同学拟对原装置加以改进.他们认为,如果在原装置的烧瓶和锥形瓶之间依次增加下列________、________(填代号)装置,即可达到实验目的.
a.装有NaOH溶液的洗气瓶
b.装有CCl4的洗气瓶
c.装有KI溶液的洗气瓶
d.装有湿润淀粉KI试纸的集气瓶
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省潍坊市高三上学期期末考试化学试卷(解析版) 题型:填空题
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+ Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+ Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。
则CO与Sx生成COS反应的热化学方程式是________________________。
(2)有人设想按如图所示装置用废气中的SO2生产硫酸。

写出SO2电极的电极反应式__________________________。
(3)提高反应2SO2(g)+O2(g)
 2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5 min后反应达到平衡,二氧化硫的转化率为50%,前5 min内SO2的平均反应速率为___________。
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是
_________(填序号)。
a.温度和容器体积不变,充入1.0molHe (g)
b.温度和容器体积不变,充入2molSO2和lmolO2
c.温度和容器体积不变,充入1.0molSO2
d.在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)
 2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组同学,在老师指导下,进行乙醇催化氧化制取乙醛,并探究乙醛发生银镜反应的最佳实验条件。7.00
I.制取乙醛。拟用如下图(图中铁架台等装置已略去)装置制取乙醛。

(1)实验前,首先检查装置的气密性,其操作是___________。
(2)分别向试管A中加入乙醇(乙醇沸点为78.50C),C中加入水。实验时,先加热B装置中的玻璃管,约1 min后鼓入空气,此时铜丝即呈红热状态。该反应的化学方程式为_________________________。
(3)撤走酒精灯,若反应物的流量控制适当,铜丝能长时间保持红热直到实验结束;若反应物量不足,铜丝红热现象就消失。如果需要提高产生乙醇蒸气的速率,可采用的方法是_____________。
(4)认真研究该实验方案后,某同学认为装置中存在不安全之处,建议装置B、C之间接上D装置,你认为这一改进是否合理_______(填“合理”或“不合理”),其理由是
___________________________________________________________________。
II.探究银镜反应的最佳实验条件。制得的乙醛是一种常用的有机试剂,在碱性和加热条件下,能与银氨溶液发生银镜反应。银镜的光亮程度与反应条件有关。
(5)在一定条件下进行分组实验,部分实验数据录入下表:

若只进行实验1和实验3,其探究的目的是 。
(6)若还要探究银氨溶液的用量对出现银镜快慢的影响,需要控制的实验条件是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com